问
SER-109在国内上市了吗


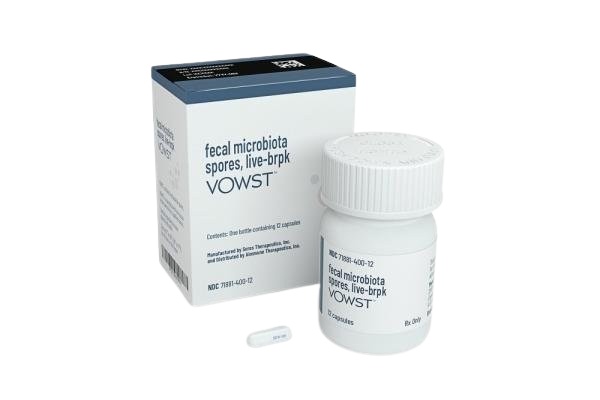
SER-109在国内上市了吗,SER-109(Fecal Microbiota Spores, live-brpk)于2023年4月27日获得美国食品药品监督管理局(FDA)的批准上市,目前国内未上市。
SER-109是一种针对艰难梭菌感染的新型治疗药物,其主要成分为活的肠道微生物菌群孢子。近年来,艰难梭菌感染(CDI)的发病率逐渐上升,给患者带来了严重的健康威胁。在国内,关于SER-109的上市进展备受关注。本文将对SER-109的相关情况进行详细探讨。
1. SER-109的背景及作用机制
艰难梭菌感染主要发生在接受抗生素治疗后,正常菌群被破坏,患者肠道内的艰难梭菌过度繁殖。SER-109作为一种微生物制剂,其作用机制是在于重建和恢复肠道微生物群的平衡。通过补充健康的微生物群,SER-109帮助抑制艰难梭菌的生长,从而降低复发的风险。
2. 国内上市的进展
截至目前,SER-109在中国的上市进展尚无明确的官方公告。根据相关信息,SER-109已经在一些国家获得批准并开展了临床应用,但具体何时在中国上市仍待相关部门的审批与监管。此外,国内市场对于此类新疗法的接受度也在逐步提高,有望为患者提供更多治疗选择。
3. 监管与审批流程
在中国,药品的上市需要经过严谨的审核和审批流程。SER-109的生产企业需要向国家药品监督管理局提交临床试验数据及药品安全性、有效性评价。此外,随着对微生物疗法认知的增加,相关法规也在不断完善。这种背景下,SER-109的上市显得尤为重要,通过有效的数据支持,能够加快其在国内的审核速度。
4. 展望未来
如果SER-109能够顺利在国内上市,将为艰难梭菌感染患者带来新的希望。患者不再仅限于传统的抗生素治疗, SER-109作为一项新兴的微生物治疗手段,能够为复发性CDI患者提供更加有效的解决方案。与此同时,也希望越来越多的创新药物能够在中国顺利上市,为公众健康贡献更多力量。
总的来说,SER-109在中国的上市情况仍需密切关注。随着医学研究的不断深入,未来有望为更多患有艰难梭菌感染的患者提供有效的治疗选择。希望这一新疗法能够快速进入市场,造福广大患者。


-
问SER-109可以用医保吗答SER-109可以用医保吗,SER-109(Fecal Microbiota Spores, live-brpk)未纳入医保。根据国家医保局相关信息,未查询到该药品被纳入医保。SER-109(粪菌微生物孢子,活菌制剂)是一种新型的治疗药物,主要用于治疗艰难梭菌感染(Clostridioides difficile infection, CDI)。这种感染可以导致严重的腹泻和其他消化系统相关症状,有时甚至会危及生命。由于其疗效显著,越来越多的患者和医生关注SER-109的医保报销政策,以便在经济上减轻患者的负担。 1. SER-109的作用机制 SER-109通过恢复肠道的健康微生物群落来抵抗艰难梭菌的生长。它由多种肠道细菌的孢子组成,这些细菌可以在肠道内形成竞争,从而抑制艰难梭菌的增殖。该药物经过临床试验显示出良好的疗效,尤其是在复发性艰难梭菌感染患者中。 2. 当前的医保政策 截至目前,SER-109在中国的医保政策尚未全面覆盖。国家医保局对新药的准入审查通常需要经过严谨的评估和评审,包括药物的临床有效性、安全性以及经济负担等多方面因素。因此,SER-109是否能够进入医保范围,还需等待进一步的官方通知。 3. 患者的经济负担 SER-109的上市价格相对较高,可能对患者造成一定的经济压力。对于大部分患者来说,尤其是低收入群体,难以一次性支付高昂的药费。因此,医保的支持将是推动SER-109广泛应用的重要因素,既有助于提高患者的治疗意愿,也能减少长期的医疗费用负担。 4. 未来的发展趋势 随着对艰难梭菌感染认知的提高以及对新治疗方法的需求增加,SER-109的应用前景被普遍看好。预计在未来,随着更多临床数据的积累以及政策的逐步完善,SER-109有可能被纳入医保目录,从而惠及更多需要治疗的患者。 SER-109作为治疗艰难梭菌感染的一种新药,显示出了良好的临床效果。医保的问题仍待进一步解决。希望随着医疗政策的改善,患者能在未来得到更好的支持和照顾。已帮助1111人2025-09-08 17:17:56
-
问SER-109国外代购多少钱一盒答SER-109国外代购多少钱一盒,SER-109(Fecal Microbiota Spores, live-brpk)的代购价格是12万元左右,请选择正规海外代购渠道,以保证产品质量。SER-109是一种针对艰难梭菌感染(Clostridioides difficile infection, CDI)的新疗法,主要以活的粪菌微生物孢子形式提供。这种治疗方法通过恢复肠道微生物群的平衡来帮助防止艰难梭菌的复发。随着对这种治疗的关注增加,许多人想了解SER-109在国外代购的价格,以及它的有效性和相关信息。 1. SER-109的基本信息 SER-109是一种新型的生物制剂,主要用于治疗重复发作的艰难梭菌感染。这种药物包含来自健康捐赠者的肠道细菌孢子,通过口服方式服用。研究表明,SER-109对于减少CDI的复发具有显著效果,尤其适合那些经历多次感染的患者。 2. 国外代购价格分析 目前,SER-109的国外代购价格因药品的来源、供给情况以及不同商家的定价策略而存在一定的差异。一般来说,一盒SER-109的价格在1000到3000美元之间。在购买时,消费者应关注产品的真伪及合规性,以确保获得合法和有效的治疗。 3. 代购渠道的选择 对于希望购买SER-109的患者,可以通过多种渠道代购,包括专业药品代购网站、国外药房等。无论选择何种渠道,务必确保其信誉及合法性,并询问是否提供相关的健康证明和使用说明。同时,建议在购买前咨询医生,确认该药物是否适合自身的病情。 4. 使用注意事项 值得一提的是,虽然SER-109在临床试验中显示出良好的疗效,但并非所有人都适合使用。在使用前,患者应与医疗专业人士进行深入交流,了解可能的副作用和风险。此外,采用正确的服用方法也至关重要,确保药物能够发挥最大效果。 随着对SER-109的关注日益增加,患者们开始重视这一疗法的有效性和安全性。在代购时,不仅要考虑价格,更需要仔细甄别渠道的合法性,保障自身的健康和权益。希望以上信息能帮助到正在寻求治疗艰难梭菌感染的患者,让他们找到合适的解决方案。已帮助1315人2025-08-31 16:48:32
-
问SER-109的副作用大不大答SER-109的副作用大不大,SER-109(Fecal Microbiota Spores, live-brpk)最常见的不良反应(在≥5%的参与者中报告)是腹胀(31.1%)、疲劳(22.2%)、便秘(14.4%)、寒战(11.1%)和腹泻(10.0%)。SER-109(Fecal Microbiota Spores, live-brpk)是一种基于细菌孢子的口服微生物菌群疗法,主要用于预防18岁以上患者在接受复发性艰难梭菌感染(CDI)的抗生素治疗后CDI的复发。该药品在临床试验中表现出色,疗效显著、安全性高,极大地提高了患者的生活质量。SER-109是一种基于活性肠道微生物的治疗方案,主要用于艰难梭菌感染(Clostridium difficile infection, CDI)的复发预防。近年来,随着对肠道菌群的研究深入,SER-109作为一种新型生物疗法逐渐受到关注。许多人对其副作用表示关心,那么,SER-109的副作用究竟大不大呢?本文将对此进行探讨。 1. SER-109的作用机制 SER-109的主要成分是活性大肠杆菌芽孢,通过重建患者的肠道微生物群落,以帮助恢复肠道健康。艰难梭菌感染常常因肠道菌群失衡而引发,SER-109通过引入健康的微生物来抑制艰难梭菌的过度生长。因此,SER-109的使用旨在降低复发率,提高患者的生活质量。 2. 临床试验结果 在临床试验中,SER-109展示了良好的疗效,并能够有效减少艰难梭菌感染的复发率。许多患者在使用后感到症状明显改善,并在随访中显示出较少的复发。值得注意的是,不同患者的反应可能存在差异。 3. 潜在副作用 虽然SER-109的总体安全性较高,但仍然存在潜在副作用。有些患者在使用过程中可能会经历腹泻、恶心或腹痛等不适。这些副作用通常是轻微且短暂的,但对于部分患者来说,可能会影响他们的治疗体验。因此,在使用SER-109时,需要与医生保持良好的沟通,及时反映身体状况。 4. 风险评估与管理 对于考虑使用SER-109的患者,进行充分的风险评估是非常重要的。医生会根据患者的具体病史、目前的健康状况以及对其他治疗的反应,来决定SER-109是否适合。同时,对于可能出现的副作用,患者应及时向医生反馈,以便进行相应的管理。 总而言之,SER-109在治疗艰难梭菌感染方面展示了良好的效果,但与所有医疗方案一样,也存在一定的副作用。通过合理的使用和医生的指导,大多数患者能够安全地受益于这一新疗法。对于副作用的担忧,患者应与医疗团队深入探讨,确保能更好地掌握自己的健康管理。已帮助1507人2025-08-14 17:46:59
-
问SER-109的使用注意事项有哪些答SER-109的使用注意事项有哪些,SER-109(Fecal Microbiota Spores, live-brpk)的注意事项:1.传染性病原体:因为Vowst是由人类粪便制造的,它可能会带来传播传染因子的风险。2.食物过敏原的潜在存在:可能含有食物过敏原。食物过敏原导致不良反应的可能性未知。在治疗艰难梭菌感染(Clostridium difficile infection, CDI)方面,SER-109是一种新兴的疗法,主要由活性粪便微生物减毒芽孢组成。随着对肠道微生物组研究的深入,SER-109作为一种微生态治疗手段,逐渐受到关注。本文将探讨SER-109的使用注意事项,包括适应症、使用前准备、潜在副作用以及后续管理等,以帮助患者和医务人员更好地理解和使用该治疗药物。 1. 适应症明确 SER-109适用于经过标准抗生素治疗后反复发作的艰难梭菌感染患者。使用前需确保患者确诊为CDI,并且具有相应的临床症状和病史。该药物主要针对那些因反复感染而导致生活质量下降的患者,因此在使用时,要严格遵循临床指引和医生的建议。 2. 使用前准备 在使用SER-109之前,患者需进行全面的身体评估。医生会考虑患者的多种健康因素,包括既往病史、其他合并症以及现有治疗方案。此外,患者在治疗前需了解SER-109的使用方式,确保自己能够顺利接受这一治疗。 3. 潜在副作用 虽然SER-109被认为是安全的,但仍存在一定的副作用风险。常见的副作用包括腹泻、腹胀及不适等,部分患者可能会出现过敏反应。在使用过程中,患者须保持警惕,若出现明显不适或异常症状,应及时与医生沟通,进行必要的评估与处理。 4. 后续管理与监测 治疗结束后,患者需要定期随访,观察艰难梭菌感染是否再次复发。医生会根据患者病情的发展,调整后续的治疗计划和随访频率。此外,患者还应坚持健康的饮食和生活方式,以支持肠道健康,减少感染复发的风险。 综上所述,SER-109在治疗艰难梭菌感染方面提供了一种新的选择,但患者在使用时必须了解相关的注意事项,以确保安全和疗效。与医生保持沟通,积极配合治疗,无疑将有助于改善治疗效果,提高生活质量。已帮助963人2025-08-12 12:39:35
