基质硬度与瓦博格效应的关键联结:CLIC1在胰腺导管腺癌中的作用新发现


2024年8月17日,上海交通大学的研究团队在著名期刊《Cell Reports》上发表了一篇题为“A CLIC1 network coordinates matrix stiffness and the Warburg effect to promote tumor growth in pancreatic cancer”的研究论文。这项研究通过临床数据、细胞实验和生物信息学分析,深入探讨了CLIC1(溶酶体膜相关蛋白1)在胰腺导管腺癌(PDAC)中的关键作用,尤其是其在基质刚度与瓦博格效应(Warburg effect)之间的联系。研究发现,CLIC1不仅促进了糖酵解代谢,推动了肿瘤的增殖,而且通过ROS/HIF1α信号通路增强了瓦博格效应,为未来PDAC的靶向治疗提供了新的方向。
背景:ECM和瓦博格效应在胰腺癌中的作用
细胞外基质(ECM)是肿瘤微环境中最重要的非细胞成分,其在维持肿瘤组织结构、传递生物化学信号以及调节肿瘤细胞生物学特性方面起着至关重要的作用。胰腺导管腺癌(PDAC)是一种以高纤维化和基质丰富为特征的恶性肿瘤,ECM的异常硬化在PDAC的进展中扮演了关键角色。由于ECM的致密性和刚度,PDAC的肿瘤微环境(TME)变得更加恶劣,不仅阻碍了药物的有效输送,还导致肿瘤细胞处于缺氧状态,进一步抑制了免疫反应。这些特征加剧了肿瘤的恶性进展,使PDAC成为一种预后极差的疾病。
瓦博格效应是指肿瘤细胞在充足氧气供应的情况下,仍然依赖糖酵解而非氧化磷酸化获取能量的现象。这一代谢特征在PDAC中尤为显著,成为肿瘤细胞生存和增殖的重要驱动力。然而,瓦博格效应的调节因子及其与ECM硬度之间的关系仍未完全阐明。
研究发现:CLIC1与瓦博格效应的关联
研究团队通过基因集富集分析(GSEA)发现,CLIC1与糖酵解途径之间存在密切联系。在高CLIC1表达的PDAC样本中,HALLMARK_GLYCOLYSIS通路显著富集,进一步证实了CLIC1在PDAC糖酵解中的关键作用。通过TCGA数据库的基因相关性分析,研究人员发现CLIC1与多个糖酵解标志物之间存在显著的正相关。
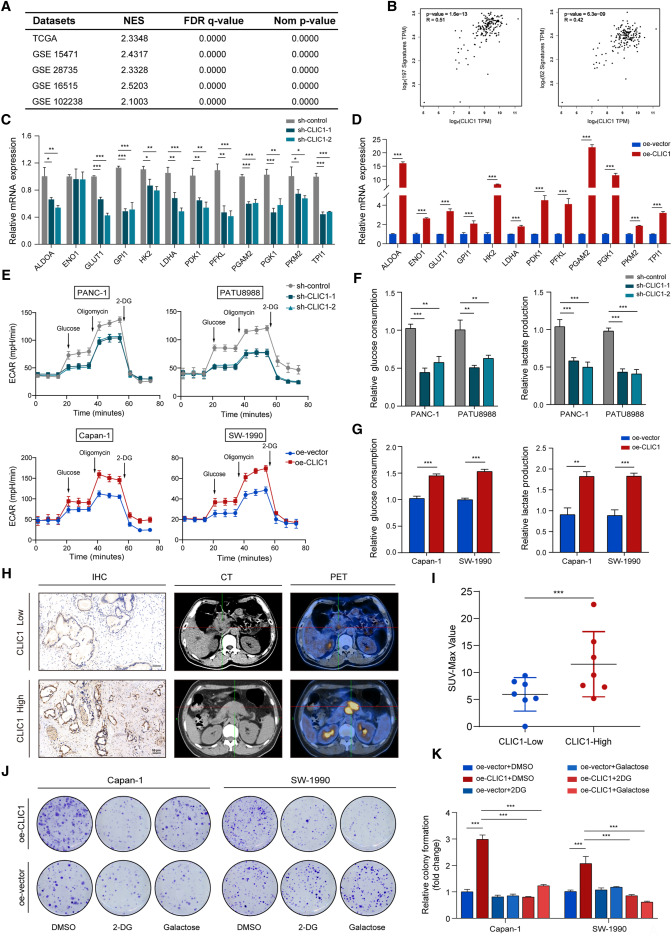
为了深入探讨CLIC1在瓦博格效应中的作用,研究人员进行了多项实验。首先,通过qPCR检测,发现CLIC1的遗传修饰显著影响了葡萄糖转运蛋白及多种糖酵解成分的mRNA表达。此外,CLIC1的敲低实验显示,细胞外酸化率显著降低,而CLIC1过表达则相反,增加了糖酵解水平。这些实验结果强烈支持了CLIC1通过调控糖酵解代谢来促进PDAC细胞增殖的假设。
在进一步的研究中,研究人员使用了糖酵解抑制剂(如2-DG和乳糖)来检测CLIC1在克隆形成能力中的作用。他们发现,抑制糖酵解显著削弱了CLIC1促进的克隆形成能力,证明CLIC1在有氧糖酵解中的促进作用是肿瘤细胞增殖的关键因素。
机制解析:CLIC1通过ROS/HIF1α信号通路增强瓦博格效应
研究还揭示了CLIC1通过ROS(活性氧簇)/HIF1α信号通路在PDAC中发挥作用的具体机制。具体来说,CLIC1通过抑制ROS的羟化反应,增强了HIF1α的稳定性,而HIF1α作为瓦博格效应的关键调节因子,进一步促进了糖酵解代谢,从而推动了肿瘤细胞的生长。
这一机制的揭示为理解CLIC1在PDAC中的作用提供了新的视角。研究结果表明,通过靶向CLIC1/ROS/HIF1α轴,可以有效抑制瓦博格效应,从而减缓或逆转PDAC的恶性进展。这为未来PDAC的治疗提供了新的靶点和干预策略。
研究意义与展望
这项研究揭示了CLIC1在PDAC中发挥的核心作用,尤其是在基质硬度与瓦博格效应之间的联结。研究结果不仅加深了对PDAC代谢重编程机制的理解,还为临床上开发新的治疗方案提供了理论基础。未来,通过靶向CLIC1及其相关的信号通路,有望为PDAC患者带来新的治疗希望,特别是在改善肿瘤微环境、抑制肿瘤代谢活性方面。
综上所述,这项研究的发现强调了同时处理肿瘤基质特性和代谢重组的重要性。CLIC1作为PDAC中的一个关键调节因子,正逐渐成为一个有前景的治疗干预点。随着进一步研究的深入,基于CLIC1的靶向治疗策略可能会为改善PDAC患者的预后提供新的可能性。