癌症诊断新突破:细胞外囊泡“巨无霸”成为液体活检的关键标记物


随着全球癌症病例持续攀升,2023年新增癌症病例预计突破2000万。前列腺癌、乳腺癌和神经胶质瘤分别位居男性、女性及神经系统肿瘤发病率之首。传统组织活检存在侵入性强且局限性大的问题,难以满足转移性癌症的动态监测需求。液体活检技术凭借其无创性和可重复性,成为了当下研究的热点。然而,现有的技术,尤其是对循环肿瘤DNA(ctDNA)的检测,其灵敏度在早期癌症中仅为50%-70%,而且不能全面反映肿瘤微环境的动态变化。

细胞外囊泡——癌症诊断的“分子集装箱”
细胞外囊泡(EVs)特别是直径超过1微米的大型原癌小体(LOs),因其含有丰富的蛋白质、RNA和DNA,正被认为是癌症诊断中的“分子集装箱”。研究表明,在晚期前列腺癌患者的血液中,LOs的数量是健康人的30倍,且与转移灶负荷呈正相关。然而,由于传统超速离心法容易丢失LOs,这些分子特征和临床价值一直未能被充分揭示。
西达赛奈医学中心的突破性研究
近日,西达赛奈医学中心及其他机构的科学家在《Cell Reports Medicine》杂志上发表了题为“Extracellular vesicle heterogeneity through the lens of multiomics”的研究。该研究运用多组学技术,首次系统性地揭示了LOs作为跨癌种液体活检标志物的潜力。
优化分离流程,提升LOs回收率
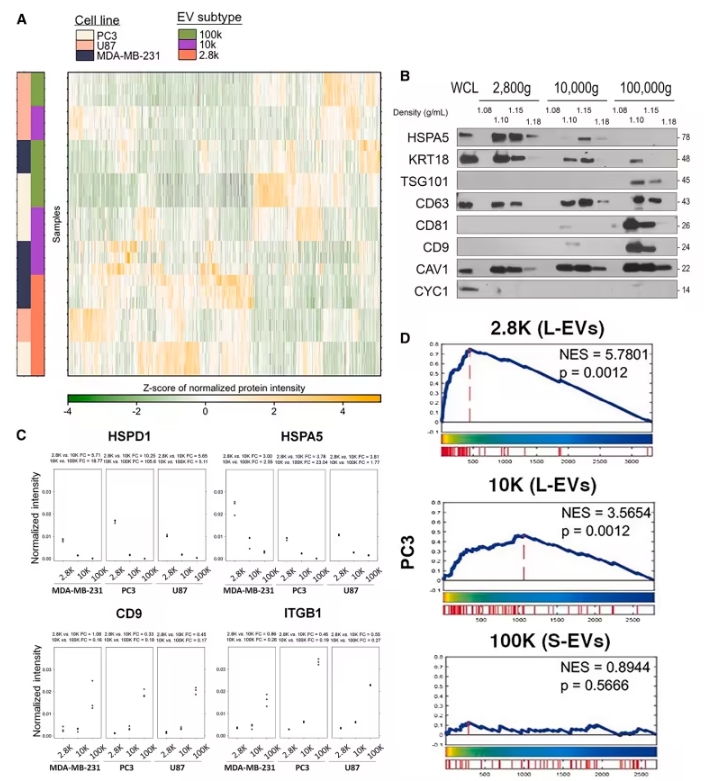
研究人员通过改进分离流程,发现LOs主要富集在低速离心(2800g)组分,而非传统的中速离心(10000g)组分。通过比较不同细胞系的EVs,包括前列腺癌(PC3)、胶质瘤(U87)、乳腺癌(MDA-MB-231),以及20例转移性前列腺癌患者的血浆样本,研究首次构建了LOs的蛋白质与转录组联合图谱。
研究突破与临床潜力
此次研究取得了多项重要突破:
LOs分离方案优化:通过优化分离流程,LOs的回收率提高了3倍;
LOs与线粒体成分的关联:LOs富含线粒体成分,能够作为代谢异常的“分子哨兵”;
LOs表面蛋白与耐药性相关:研究发现LOs表面蛋白与激素治疗耐药显著相关。
LOs在液体活检中的重要性
通过蛋白组学分析,研究在患者血浆LOs中鉴定出了2933种蛋白质,其中56.6%为跨癌种共享标志物。转录组学分析揭示LOs中特别富集线粒体转录本(如MT-CO1),其含量是小型EVs的8倍。在临床验证中,7种LOs标志物在转移性去势抵抗性前列腺癌(mCRPC)中表现出较局限性癌症高4.2倍的表达量。
此外,LOs中线粒体蛋白(如HSPD1、HSPA5)和内质网蛋白(如RPN2)的富集度是小型EVs的15倍,质膜蛋白(如CD9、ITGB1)则主要存在于小型EVs中。
LOs富集提高癌症相关蛋白检出率
通过LOs富集,癌症相关蛋白的检出率提高了51.2%,信噪比提升了8倍。动物实验表明,抑制LOs关键酶DDHD2能够显著延缓肿瘤转移(p=0.003)。
LOs的临床应用前景
这项研究打破了细胞外囊泡越小越有价值的传统认知,揭示了LOs作为“分子集装箱”的三重价值:
为代谢异常肿瘤提供新的生物标志物;
为稀有细胞外囊泡亚群的分析建立新的范式;
用于动态监测耐药性演变。
研究发现,CD44/ATP5B组合对转移性去势抵抗性前列腺癌的AUC达到了0.89。未来,研究人员将继续探索LOs的细胞来源机制及其与循环肿瘤细胞(CTC)的协同诊断价值。基于LOs表面标志物的免疫捕获技术有望使LOs的检测成为临床常规项目。
结论:LOs在癌症早期检测中的潜力巨大
通过优化的分离和分析技术,LOs已显示出作为液体活检标记物的巨大潜力,为癌症的早期检测和动态监测开辟了新的道路。随着更多研究的深入,LOs或将成为癌症诊断的“黄金标记物”,并有可能在未来广泛应用于临床诊断中。