博安生物首款度拉糖肽生物类似药获批上市


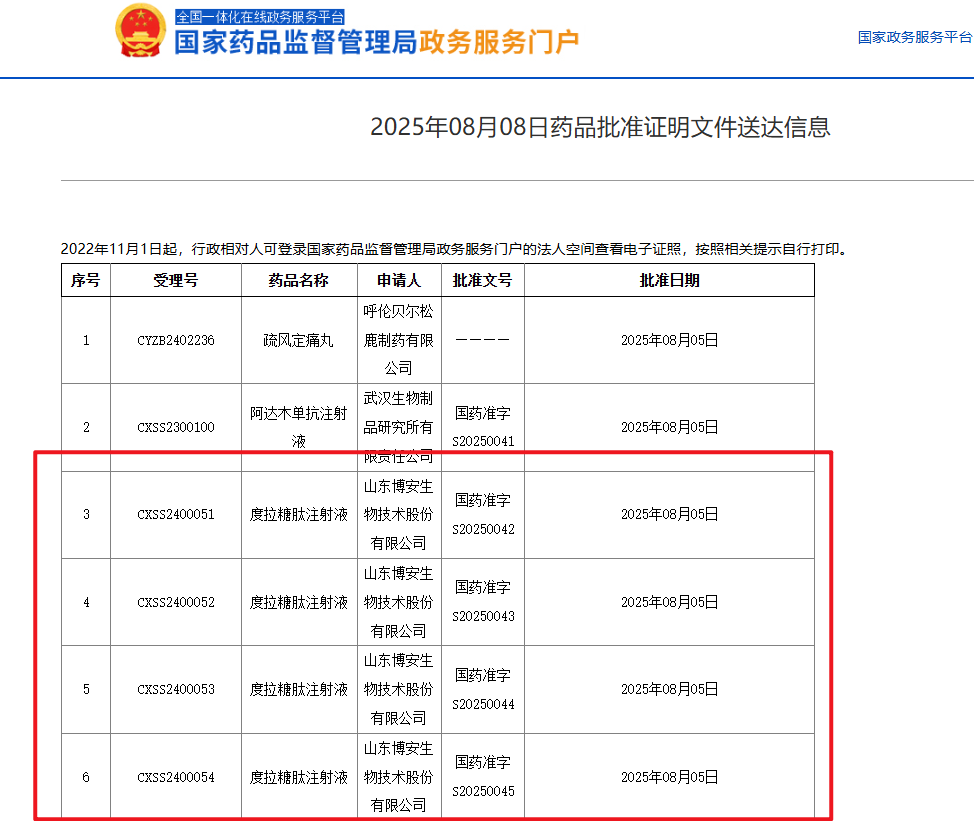
8月8日,国家药监局(NMPA)在官网发布消息,博安生物(绿叶制药旗下公司)的度拉糖肽注射液(BA5101,LY05008)已获批准上市。这是中国首款获批的度拉糖肽生物类似药,旨在用于成人2型糖尿病患者的血糖管理。
原研度拉糖肽的治疗优势
度拉糖肽由礼来公司开发,属于长效GLP-1受体激动剂,每周注射一次。与其他降糖药相比,度拉糖肽能够有效改善胰岛β细胞的功能,持续稳定地降低血糖和糖化血红蛋白(HbA1c)水平。其最大的优势在于:不易引起低血糖,能帮助减少体重,改善血脂水平,还具有显著的心血管保护效果,对肾脏也能起到一定的保护作用。此外,度拉糖肽每周注射一次的便捷给药方式,能够有效提升患者的用药依从性。据礼来公司2024年的财报显示,度拉糖肽全球销售额已达52.535亿美元。
BA5101的临床研究与疗效验证
博安生物的度拉糖肽生物类似药BA5101的研发符合中国、美国、欧盟等生物类似药的相关研究指南。在中国开展的III期临床试验采用随机、开放、平行、阳性对照设计,结果显示BA5101在成人2型糖尿病患者中的疗效与原研产品相当,能够快速且稳定地降低血糖和糖化血红蛋白(HbA1c),并且其安全性和耐受性良好。
具体来说,在治疗12周后,BA5101组的HbA1c水平下降了1.44%,而度拉糖肽组为1.41%,二者差异仅为0.06%(95% CI:-0.08%,0.19%),结果证明两者在疗效上等效。此外,I期临床试验表明,BA5101与度拉糖肽原研产品在药代动力学(PK)特征、安全性及免疫原性方面高度相似,相关结果已发表在国际学术期刊《Expert Opinion on Biological Therapy》上。
高技术壁垒的突破
度拉糖肽作为一种融合蛋白,其生物类似药的研发面临较高的技术壁垒。博安生物在开发过程中,成功攻克了度拉糖肽在氧化、断裂、电荷异质性等方面的技术难题,确保了BA5101在理化特性和生物学活性上与原研产品的高度一致性。
未来展望与市场潜力
BA5101的获批上市不仅为中国2型糖尿病患者提供了更多的药物选择,也为博安生物在全球生物类似药市场的布局奠定了基础。随着度拉糖肽在糖尿病治疗中的逐渐普及,BA5101有望成为国内市场的重要竞争者,满足患者日益增长的治疗需求。
通过攻克高难度的技术难题,博安生物不仅提升了自有研发能力,也为未来更多生物类似药的研发积累了宝贵经验。