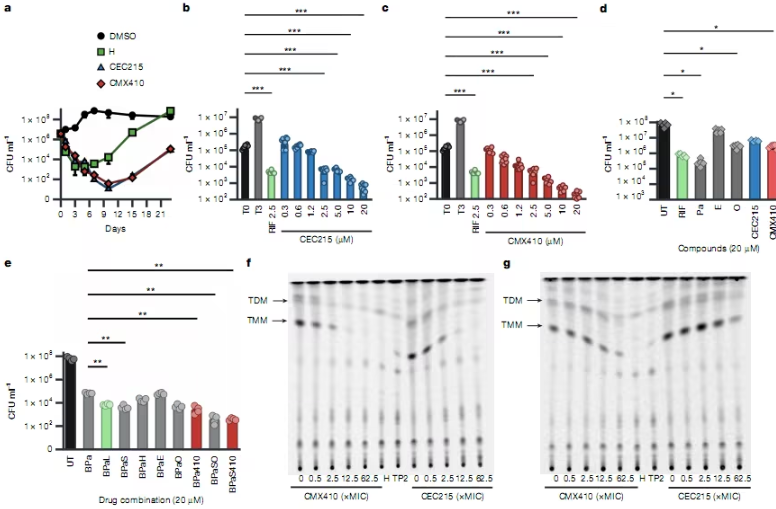
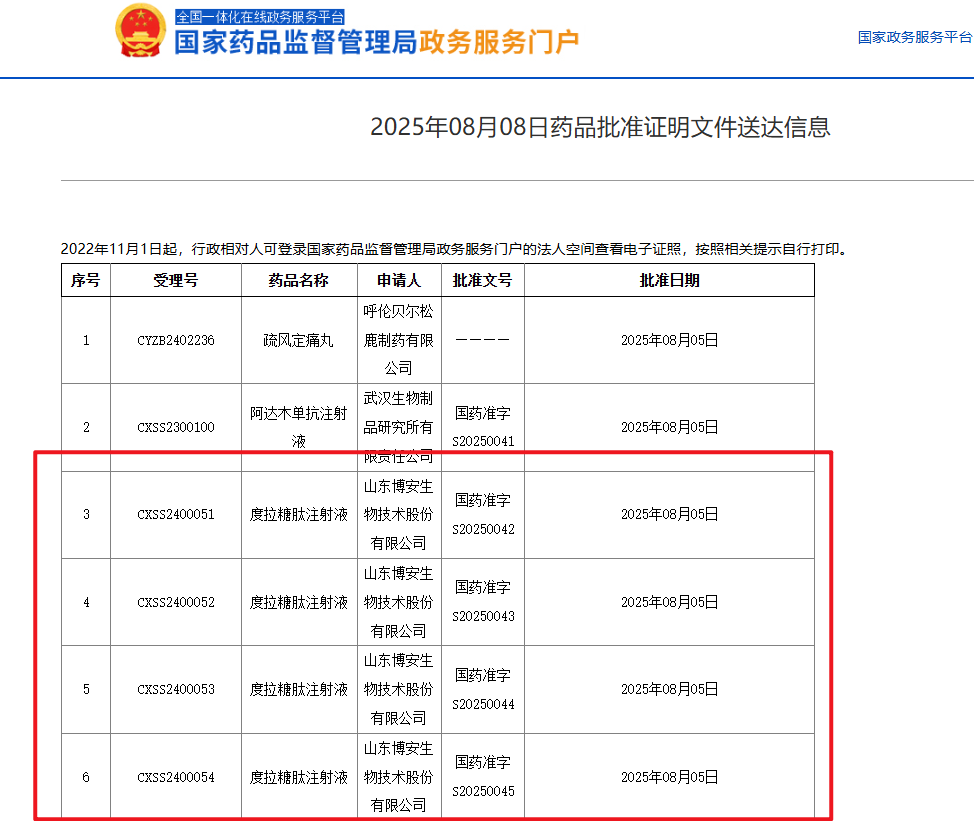
全球首个原位转分化创新药NRG-103注射液获FDA IND批准,即将开启胶质母细胞瘤临床研究


2025年8月11日,纽伦捷生物医药科技有限公司(以下简称“纽伦捷生物”)宣布,其自主研发的全球首款基于原位转分化技术的创新药——NRG-103注射液,已正式获得美国食品药品监督管理局(FDA)新药临床试验(IND)批准。这一突破性研发将推动胶质母细胞瘤(GBM)治疗向前迈出坚实一步。
胶质母细胞瘤治疗的“拦路虎”
胶质母细胞瘤作为最常见和侵袭性极高的原发性颅脑肿瘤,在临床治疗中面临着巨大的挑战,其高度侵袭性生长和显著遗传异质性使现有治疗效果十分有限。几乎所有患者仍面临瘤体复发和低长期生存率的问题,因此开发全新的治疗方法势在必行。
NRG-103注射液:突破性的“双重机制”创新疗法
NRG-103注射液是纽伦捷生物在其原位转分化技术平台上开发的革命性疗法。针对胶质母细胞瘤的生物复杂性与当前治疗局限,这一创新药通过“溶瘤病毒免疫杀伤+原位细胞转分化”的双重机制,提出了根本性解决肿瘤复发与逃逸的策略:
溶瘤病毒选择性杀伤肿瘤细胞:利用新一代溶瘤病毒设计,精准攻击并杀死肿瘤细胞;
原位转分化技术抑制肿瘤复发:将残余的肿瘤细胞直接转化为非增殖的功能性细胞,从源头解决癌症躲避免疫杀伤和复发的难题。
这一双重机制在早前的研究中已展现出显著成果,其技术平台也在2024年科技部全国颠覆性技术创新大赛中荣获总决赛优胜奖。
FDA批准标志着原位转分化新疗法的里程碑
在2025年4月,NRG-103注射液已获得FDA授予的孤儿药资格认证(ODD),为此次IND申请铺平了道路。而此次NRG-103注射液获准进入正式临床试验,标志着其成为全球首个正式开展原位转分化疗法临床研究的产品。
FDA的IND批准,是对纽伦捷生物的技术平台和突破性创新的权威认可,也在全球范围内确立了原位转分化疗法的重要里程碑。这为原发性脑肿瘤的治疗开辟了全新路径,也为生物医药行业探索精准、高效的抗癌方案提供了重要推动力。
初步研究成绩:安全与疗效信号为后续研究奠定基础
NRG-103注射液此前已在中国进行了一项研究者发起的临床研究,该研究已初步验证了其安全性,并显示出积极的疗效信号。这些研究数据为正式注册的临床试验提供了扎实的基础,进一步为该疗法在全球范围内的实际应用奠定了信心。
纽伦捷生物:持续创新推动多领域突破
纽伦捷生物凭借其具备全球领先水平的转分化因子技术平台和药物递送载体开发平台,除了在肿瘤领域布局外,还积极拓展至多个前沿医学方向,其中包括视网膜退行性疾病、中枢神经系统损伤、退行性疾病等。公司注重差异化创新,在全球范围内持续开发兼具科学理论与临床转化潜力的创新药物,为更多患者带去先进的治疗方案。
科技认可与未来展望
2025年6月,纽伦捷生物成功入选科技部首届全国颠覆性技术创业之星榜单,再次印证了其在技术研发及创新领域的领先地位。未来,随着临床试验的推进,NRG-103注射液有望成为胶质母细胞瘤治疗领域的新突破,为全球数百万患者提供更有效的治疗选择。
结语
NRG-103注射液获FDA IND批准,开启了针对胶质母细胞瘤的临床研究,也为原位转分化疗法领域树立了新的标杆。这一创新药物的开发和应用将为癌症治疗提供全新的思路,未来有望惠及更多癌症患者,为攻克复杂难治肿瘤带来曙光。