国产首款!亚盛医药创新Bcl-2抑制剂「利沙托克拉」获批上市


7月10日,国家药品监督管理局(NMPA)官网正式公布,亚盛医药自主研发的新型口服Bcl-2选择性抑制剂利沙托克拉片(APG-2575)已获批准上市,用于治疗复发或难治性(R/R)慢性淋巴细胞白血病(CLL)及小淋巴细胞淋巴瘤(SLL)。这是中国首个获得明确疗效并成功进入关键注册阶段的Bcl-2抑制剂,填补了该领域的市场空白,同时为血液肿瘤患者提供了新的治疗选择。
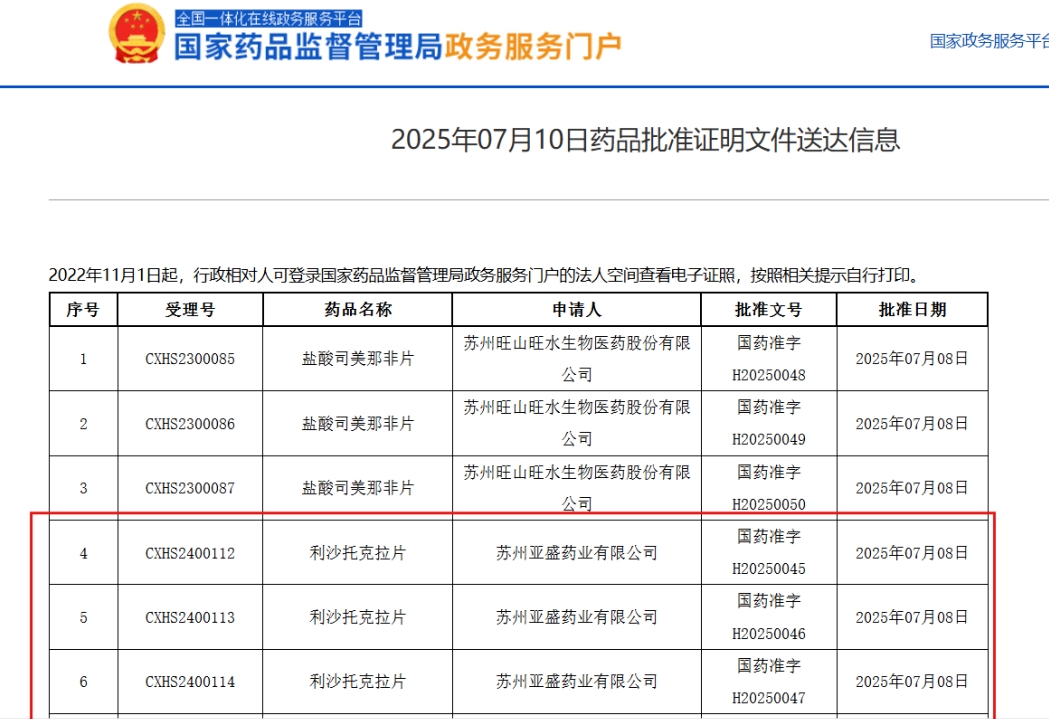
利沙托克拉:由中国自主研发的创新Bcl-2抑制剂
利沙托克拉片是亚盛医药推出的一款靶向Bcl-2蛋白的创新药物。作为全球第二款进入注册阶段的Bcl-2抑制剂,以及中国首款独立研发并获批的新药,利沙托克拉通过干预癌细胞的关键蛋白具有显著的治疗潜力。
独特机制:
Bcl-2是一种凋亡抑制因子,可通过调控线粒体膜的通透性来延缓细胞死亡过程。肿瘤细胞往往依赖其过度表达以逃避凋亡机制。
利沙托克拉通过选择性抑制Bcl-2蛋白,恢复癌细胞的凋亡程序,特别在CLL/SLL等恶性血液肿瘤中表现出良好的疗效。
研发突破:
Bcl-2靶点成药难度大,全球从发现这一靶点到首次成功开发药物历时近40年。利沙托克拉不仅是自主研发的成果,还突破了这一靶点的局限性,展现出广阔的应用潜力。
关键临床研究支持:疗效显著,安全性良好
利沙托克拉的获批基于中国关键注册II期临床研究(APG2575CC201),针对R/R CLL/SLL患者的治疗效果与安全性进行了评估。尽管具体研究数据尚未公布,但亚盛医药通过国际会议透露了其联合治疗的临床表现。
1. 联合治疗最新数据
在第66届美国血液学会(ASH)年会上,亚盛医药披露了利沙托克拉联合阿可替尼与利妥昔单抗治疗CLL/SLL的初步数据:
疗效强劲:
接受利沙托克拉联合阿可替尼治疗的87例患者中,总缓解率(ORR)高达98%。
中位缓解持续时间(DOR)和中位无进展生存期(PFS)尚未达到,表现出持久疗效。
维奈克拉耐药患者的数据:
在14名维奈克拉难治或不耐受患者中,ORR为86%,12个月PFS率为84%,18个月PFS率为73%。
在其中9例维奈克拉难治患者中,ORR进一步提升至89%,18个月PFS率高达89%。
2. 良好安全性
利沙托克拉的治疗相关不良事件(TEAEs)发生率低,且未出现显著严重的毒性问题。其安全性表现稳定,为R/R患者提供新药选择时保证了治疗的舒适度。
CLL/SLL与治疗需求:疾病复杂性与亟需突破
CLL/SLL是一类成熟淋巴B细胞引发的增殖性肿瘤,多发于老年人群,是欧美最常见的成人白血病类型。全球每年新增病例超过10万例。
中国CLL/SLL特点:
CLL/SLL在中国的发病率低于欧美,但近年来呈显著增长趋势,同时患者发病年龄更低且侵袭性更强,更加难以治疗。
现有治疗的局限:
虽然免疫化疗以及布鲁顿酪氨酸激酶抑制剂(BTKi)等大幅改善了初治患者预后,但对于复发和耐药的患者,现有治疗方案仍存在明显的局限性,亟需新的安全、高效的疗法。
Bcl-2靶点革命:改写难治性血液肿瘤治愈路径
Bcl-2抗癌机制:
Bcl-2通过控制线粒体功能和抑制细胞色素C的释放来阻断细胞凋亡。其在肿瘤细胞中的过表达是抵抗凋亡机制的重要原因。
药物突破价值:
艾伯维的维奈克拉是全球首款上市的Bcl-2抑制剂,为CLL/SLL治疗树立了标杆。
利沙托克拉作为中国首个该领域创新药物,打破了国产药物的技术壁垒,为血液肿瘤治疗提供了更多选择,具有深远意义。
未来展望:全球扩张与多适应症开发
目前,利沙托克拉已进入全球注册III期临床试验阶段,适应症覆盖CLL/SLL、AML(急性髓系白血病)、MDS(骨髓增生异常综合征)等多种血液肿瘤。其中部分试验已获美国FDA许可,国际化路径显著。
适应症扩展:
利沙托克拉在恶性血液肿瘤中展现出良好的治疗潜力,其单药及联合治疗方案或可进一步优化更多适应症治疗模型。
国际布局:
亚盛医药通过国内注册基础与全球临床布局,力图夯实自主创新药物在国际市场的地位,用更精准的疗法造福全球患者。
结语:国产创新药物的里程碑
利沙托克拉片的获批不仅为复发和难治性CLL/SLL患者带来了新的希望,也标志着国产药物在基于高难度靶点的药物开发领域取得了重大突破。未来,随着更多适应症的探索与国际化临床试验的推进,利沙托克拉将成为中国药企在全球抗肿瘤治疗领域的重要贡献力量。