天然产物的抗癌密码:苯甲醛可能阻断胰腺癌扩散和耐药


近年来,癌症治疗的难点主要集中在肿瘤的耐药性和转移,全球超过90%的癌症死亡病例与转移相关。化疗、靶向治疗及放疗的耐药性也限制了疗效,如何突破这些瓶颈已成为科学家关注的重点。天然产物以其毒性低、多靶点特性备受研究者青睐。其中,苯甲醛(Benzaldehyde,BA)作为一种广泛存在于杏仁、无花果等水果中的芳香醛,早在20世纪80年代便被发现具有抑制肿瘤潜力。然而,由于当时技术和社会因素的制约,其开发并未能深入推进。
近日,日本藤田保健卫生大学等机构在《British Journal of Cancer》发表了最新研究,首次揭示苯甲醛通过表观遗传调控干预胰腺癌扩散和耐药的机制。这项研究重新审视了苯甲醛的抗癌潜力,为开发胰腺癌新型疗法提供了新视角。

研究设计:从细胞实验到动物验证,揭示苯甲醛的抗肿瘤机制
研究团队设计了一系列细胞实验与动物模型,深入探索苯甲醛的作用机制。
21种癌细胞系及耐药模型:
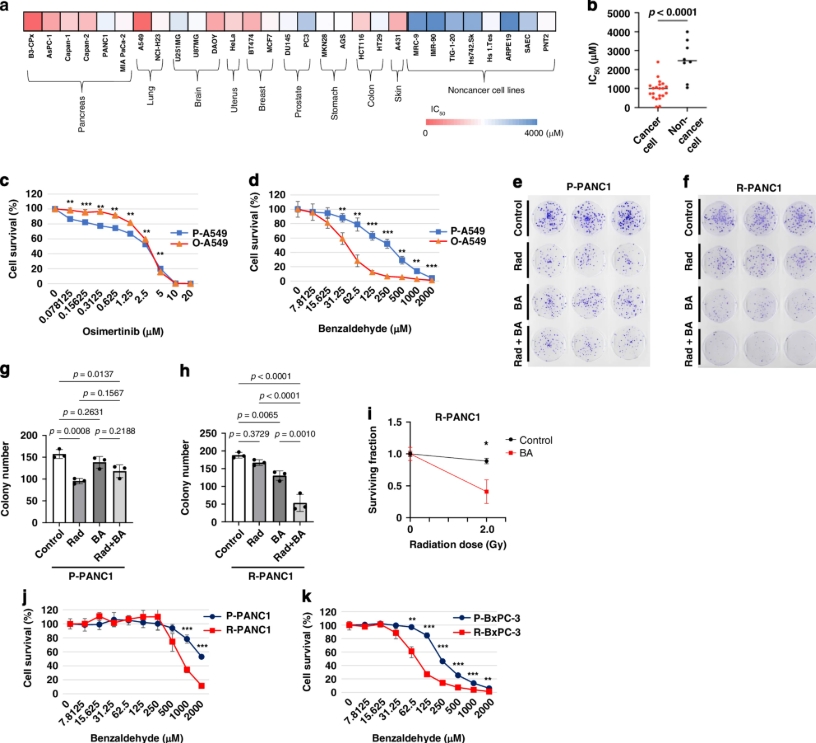
选取了21种人源癌细胞系(如胰腺癌BxPC-3、肺癌A549)及8种非癌细胞系,采用XTT法测定苯甲醛的半数抑制浓度(IC50)。结果显示苯甲醛对癌细胞毒性显著高于正常细胞。
构建奥希替尼耐药(O-A549)和放疗耐药(R-PANC1)模型,证实苯甲醛能显著抑制耐药细胞增殖,并与放疗联用具协同效应。
分子机制解析:
免疫共沉淀与Pull-down实验:苯甲醛通过乙酰化修饰破坏14-3-3ζ与客户蛋白(如c-Raf、STAT3)的结合,失活下游mTOR及ERK通路。
组蛋白修饰分析:苯甲醛能降低耐药细胞中过度表达的磷酸化组蛋白H3(H3S28ph)水平。
基因表达谱分析:微阵列分析显示苯甲醛能下调E2F2、LIN28B等上皮-间质转化(EMP)相关基因,并通过RT-qPCR进一步证明其基因调控作用。
动物模型验证:
在胰腺癌Kras/Trp53突变小鼠模型中,苯甲醛衍生物CDBA显著抑制肿瘤生长及肺转移,同时减少EMP特性细胞群和转移灶数量。
机制解析:苯甲醛通过“14-3-3ζ-H3S28ph”轴抑制耐药和转移
研究发现,耐药癌细胞可能更加依赖苯甲醛靶向的“14-3-3ζ-H3S28ph”轴,这一机制成为奥希替尼与放疗耐药的新突破点。
阻断关键蛋白互作:
苯甲醛通过非HDAC6依赖的乙酰化机制破坏14-3-3ζ蛋白与H3S28ph组蛋白的结合,逆转耐药性,并有效抑制EMP相关基因(如E2F2、ID1)转录。
恢复疗法敏感性:
阻断H3S28ph-14-3-3ζ通路后,耐药癌细胞重新对常规疗法(如奥希替尼、放疗)敏感,显著降低转移能力。
双功能抗癌策略:
不仅抑制癌细胞扩散,还直接对耐药细胞群形成杀伤作用。这一双效机制为胰腺癌等难治性肿瘤提供了新的治疗方案。
创新之处:苯甲醛与表观遗传调控的首次关联
这项研究首次将苯甲醛的抗癌作用与表观遗传调控直接关联,提出了“14-3-3ζ-H3S28ph-E2F2”轴作为耐药和转移的共同枢纽。相比广谱抑制剂,苯甲醛通过靶向蛋白互作的非HDAC依赖机制,避免了传统抑制剂可能带来的副作用。
相关启示:天然产物在癌症治疗中的应用前景
苯甲醛作为一种源于水果的天然产物,不仅具备低毒性和多靶点特性,还有助于减少副作用,提升治疗耐受性和安全性。这项研究为天然产物在癌症治疗领域提供了新的可能。
未来优化方向:
针对苯甲醛衍生物CDBA的靶向递送方式进行优化,以提升药物选择性。
探索与现有疗法(如免疫治疗、靶向治疗)的联合使用方案,扩展其应用范围。
研究延展:
跨疾病适应症的研究将进一步验证其在其他难治性肿瘤中的潜力。
结语:重新审视苯甲醛的抗癌潜力
该项研究以全新的视角重新激活了苯甲醛的抗癌开发潜力。通过其对胰腺癌耐药与转移机制的精准干预,苯甲醛及其衍生物有望成为未来癌症治疗的重要补充。未来研究团队将继续优化该药物设计,并探索更多临床应用可能,为癌症患者带来更安全、更高效的治疗选择。