艾力斯申报伏美替尼新适应症:针对EGFR exon 20插入突变的非小细胞肺癌


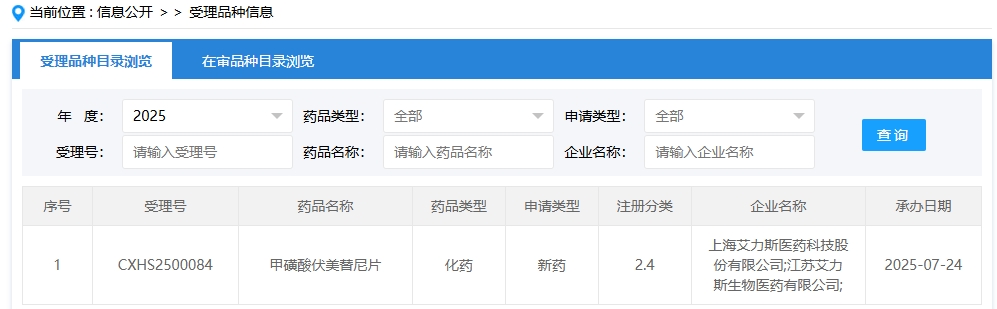
7月24日,艾力斯宣布其甲磺酸伏美替尼片在中国正式提交了新适应症申请,目标治疗人群为既往接受过含铂化疗但疾病仍进展、或因不耐受含铂化疗而未能获得良好治疗效果的成人局部晚期或转移性非小细胞肺癌(NSCLC)患者,且经基因检测确诊存在EGFR外显子20插入突变(EGFR exon 20ins)。此次申请被纳入优先审评,申请依据为一项单臂临床试验结果。
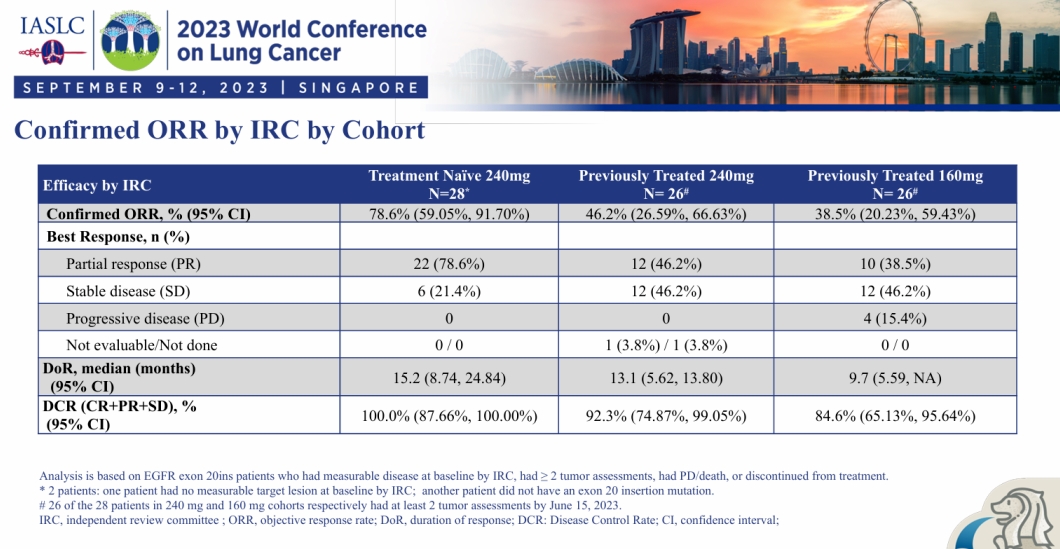
伏美替尼在EGFR exon 20插入突变非小细胞肺癌中的疗效数据
在2023年世界肺癌大会(WCLC)上,艾力斯披露了伏美替尼治疗EGFR exon 20ins非小细胞肺癌的I期FAVOUR研究结果。该研究纳入了30例初治患者以及28例经治患者,并评估了伏美替尼在不同剂量下的疗效。研究结果显示:
初治患者使用伏美替尼(240mg,每日1次)治疗后的客观缓解率(cORR)为78.6%(22/28)。
经治患者使用伏美替尼(240mg,每日1次)治疗后的cORR为46.2%(12/26)。
另外,28例经治患者在使用伏美替尼(160mg,每日1次)治疗后,cORR为38.5%(10/26)。
这些数据表明,伏美替尼在EGFR exon 20插入突变的非小细胞肺癌患者中,尤其是初治患者,显示出显著的治疗效果。
伏美替尼的上市进程与现有适应症
伏美替尼自2021年3月获得中国国家药品监督管理局(NMPA)附条件批准上市,主要用于治疗经EGFR靶向药物治疗后出现T790M突变的局部晚期或转移性非小细胞肺癌成人患者。2022年6月,伏美替尼的该适应症转为常规批准。此番新适应症的申请,标志着伏美替尼在非小细胞肺癌治疗领域的进一步拓展,尤其是在EGFR exon 20插入突变这一难治类型中的应用。
优先审评的意义
此次申请被纳入优先审评意味着,CDE(国家药品监督管理局药品审评中心)将在审核过程中给予更多的资源支持,加速审批流程。对于患者而言,若该新适应症最终获得批准,将为EGFR exon 20插入突变的非小细胞肺癌患者提供新的治疗选择,尤其是那些对传统治疗反应不佳的患者。
结语:为患者带来新的希望
伏美替尼作为一种具有创新性的靶向治疗药物,展现了在治疗EGFR exon 20插入突变非小细胞肺癌方面的强大潜力。如果本次申请顺利获得批准,伏美替尼将在进一步扩展其市场份额的同时,也为该类肺癌患者带来新的治疗希望。艾力斯的这一进展无疑将推动非小细胞肺癌治疗的进步,并为广大患者提供更多的选择。