中山大学徐瑞华团队发现:肠道菌Alistipes finegoldii可提升癌症免疫治疗效果


近年来,免疫疗法彻底改变了癌症治疗的方式,但免疫治疗耐药性仍是阻碍其广泛应用的主要问题。中山大学肿瘤防治中心徐瑞华教授团队近期的研究表明,通过针对肠道微生物群的调节,有望进一步增强免疫疗法的抗肿瘤效果,为癌症治疗带来新的希望。
研究亮点:肠道菌如何增强免疫治疗?
2025年7月24日,徐瑞华团队在Cell子刊《Cancer Cell》发表了一篇题为《Alistipes finegoldii augments the efficacy of immunotherapy against solid tumors》的研究论文,该文章首次揭示了肠道细菌Alistipes finegoldii在增强实体瘤免疫治疗中的潜在作用机制。

研究团队发现,在多种癌症免疫治疗中的队列数据中,高丰度的Alistipes finegoldii与更好的治疗反馈密切相关。进一步的实验显示,这种肠道细菌能够通过CXCL16-CXCR6信号轴,提高肿瘤微环境中CD8+ T细胞的招募,从而显著提升免疫治疗尤其是抗PD-1抗体的疗效。
作用机制:Alistipes finegoldii如何激活免疫反应?
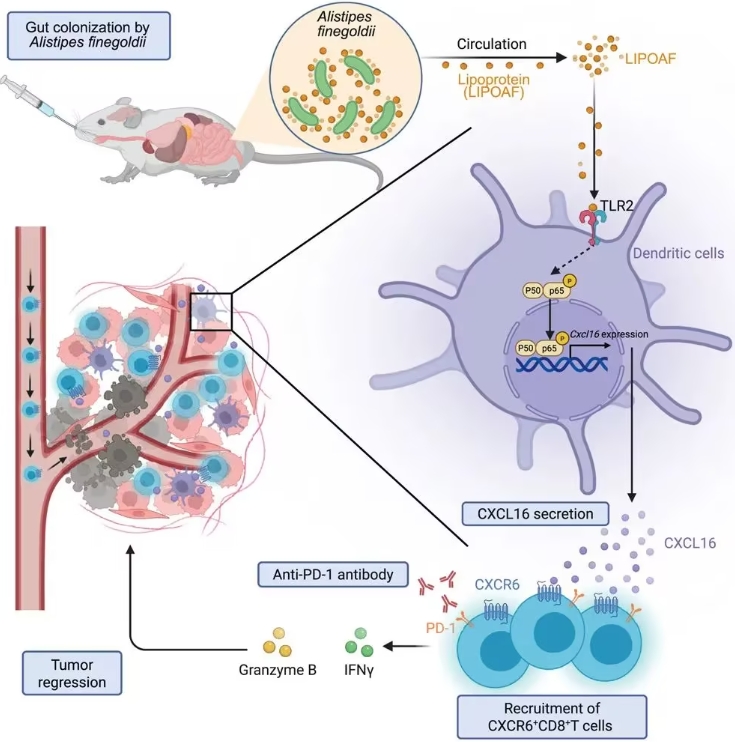
研究中揭示了Alistipes finegoldii增强抗肿瘤免疫效应的分子机制。其关键在于细菌所释放的特定脂蛋白(LIPOAF),这一蛋白通过结合Toll样受体-2(TLR2),激活NF-κB信号通路,进而在CCR7+常规树突状细胞中增强CXCL16的表达。CXCL16的释放作用于CXCR6+ CD8+ T细胞,显著促进其向肿瘤微环境(TME)的迁移,带动免疫系统对肿瘤的强效抑制。这一完整的信号链条包括:
Alistipes finegoldii产生LIPOAF,与TLR2结合;
激活NF-κB通路,增强CXCL16在树突状细胞中的表达;
CXCL16释放帮助CXCR6+ CD8+ T细胞进入肿瘤微环境;
抑制肿瘤生长并提升免疫疗法疗效。
研究核心发现
本研究在实体瘤免疫疗法领域实现了多项关键突破:
Alistipes finegoldii与免疫治疗效果改善直接相关:数据显示,在多队列免疫治疗患者群中,这种肠道细菌的高丰度与更好的临床反应显著相关。
增强抗PD-1单抗疗效:实体瘤模型中,Alistipes finegoldii在联合抗PD-1单抗治疗时明显提升了肿瘤抑制效果。
激活CXCL16-CXCR6信号轴: Alistipes finegoldii通过增强CD8+ T细胞在肿瘤微环境中的免疫活动,推动了抗肿瘤免疫反应。
脂蛋白触发TLR2-NF-κB-CXCL16通路:脂蛋白LIPOAF是这一调节机制的核心,从分子层面解开了肠道菌增强免疫治疗效果的奥秘。
治疗实体瘤的新策略:肠道菌与免疫疗法相结合
这项研究不仅揭示了肠道微生物群与免疫治疗之间的深层次联系,更提出了一项创新性治疗策略:将Alistipes finegoldii与免疫疗法联合应用,有望为治疗实体瘤开辟新途径。这种联合疗法通过提高肿瘤微环境内的免疫效率,为临床治疗提供强有力支持,也有望缓解免疫治疗耐药性问题。
未来展望
该研究为肠道微生物群在癌症免疫治疗中的作用开辟了广阔的新天地。随着肠道菌研究的深入,更多类似Alistipes finegoldii的微生物有可能成为癌症治疗的关键工具。此外,通过靶向调控肠道菌群,还可能进一步优化现有免疫疗法的疗效。未来在临床实践中应用肠道菌群联合治疗机制时,有望为癌症患者带来更多治愈机会。
徐瑞华团队的研究不仅加强了对肠道微生物与免疫治疗的理解,也为科学家探索基于微生物的癌症治疗提供了重要思路,推动癌症治疗格局走向更精准、更高效的方向。