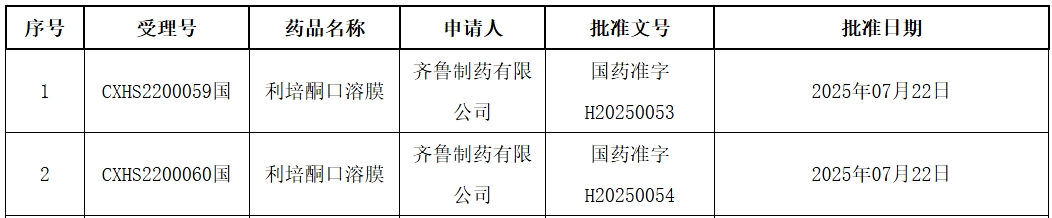
阿斯利康PD-L1单抗度伐利尤单抗申报新适应症,助力胃癌围手术期治疗


7月28日,阿斯利康宣布其PD-L1单抗药物Imfinzi(度伐利尤单抗)的新适应症补充生物制品许可申请(sBLA)已获美国食品药品监督管理局(FDA)受理,并被纳入优先审评程序。同时,FDA预计将在2025年第四季度作出审批决定。一旦获批,Imfinzi联合标准化疗方案(FLOT化疗方案,即氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛)治疗,将成为胃癌领域第一个围手术期免疫治疗方案,开创新的治疗模式。

胃癌治疗的重大突破:围手术期免疫疗法
此次sBLA申请基于Imfinzi在III期MATTERHORN研究中所取得的积极成果,该研究是一项全球多中心随机双盲安慰剂对照试验,旨在评估度伐利尤单抗联合FLOT化疗方案对比安慰剂联合FLOT化疗方案治疗可手术切除的II期至IVA期胃癌和胃食管交界处癌症(GEJ)患者的疗效和安全性。
研究主要结果
MATTERHORN研究纳入总计948例患者,主要终点为无事件生存期(EFS)。试验结果显示:
度伐利尤单抗组的EFS显著延长(尚未达到 vs 32.8个月,HR=0.71),数据具有统计学和临床意义。
1年EFS率更高:度伐利尤单抗组 78.2% vs 安慰剂组 74.0%。
2年EFS率差异更显著:度伐利尤单抗组 67.4% vs 安慰剂组 58.5%。
关键次要终点:总生存期(OS)
虽然还未进行最终分析,度伐利尤单抗组在OS方面呈现有益趋势(HR=0.78),显示出潜在的生存优势,后续评估将进一步确认这一终末点。
安全性与手术完成率
度伐利尤单抗与FLOT方案的安全性与每种药物既定特征一致。
两个治疗组的患者手术完成率相似,且严重不良事件(≥3级)发生率相近,为临床使用提供了保障。
胃癌:全球疾病负担显著且治疗需求迫切
胃癌是全球第五大常见癌症,同时也是癌症死亡率第五大原因。尽管可切除胃癌患者通常通过联合手术和化疗实现治愈,但复发率仍然较高。数据显示:
四分之一的胃癌患者在术后一年内发生疾病复发。
四分之一的患者生存期不足两年。
在五年内存活的患者不到一半。
因此,围手术期治疗策略的优化是显著提高患者生存预后的重要环节,而度伐利尤单抗联合化疗的免疫治疗方案有望为胃癌治疗模式带来突破。
胃癌患者群体显著增长:治疗需求不断攀升
据统计预测:
2024年,美国、欧盟及日本合计将有约43000名早期或局部晚期胃癌及胃食管交界部癌症患者接受药物治疗。
2030年,这一数字预计将攀升至62000例。
如此庞大的患者群体凸显了围手术期治疗创新的重要性,度伐利尤单抗的新适应症如获批,将填补胃癌治疗领域的部分空白,在全球范围内惠及越来越多的患者。
意义深远:胃癌免疫疗法的开创性进展
阿斯利康通过MATTERHORN研究,不仅展示了度伐利尤单抗在围手术期胃癌治疗中的显著疗效,还证明了免疫疗法可在早期和局部晚期胃癌患者中起到重要作用。作为胃癌围手术期首个免疫治疗方案,若成功获批,将为临床实践提供新的选择,同时也开辟了未来免疫治疗在其他可手术癌症领域应用的新方向。
未来展望
阿斯利康的度伐利尤单抗申报新适应症无疑是胃癌治疗领域的关键里程碑。随着全球胃癌患者数量的增加与治疗需求的升级,围手术期治疗继续朝着精准化与个性化方向发展。阿斯利康的创新努力不仅可能显著改善患者生存预后,还将推动胃癌治疗进入免疫疗法新纪元,为更多患者带来生存希望和生活质量的提升。