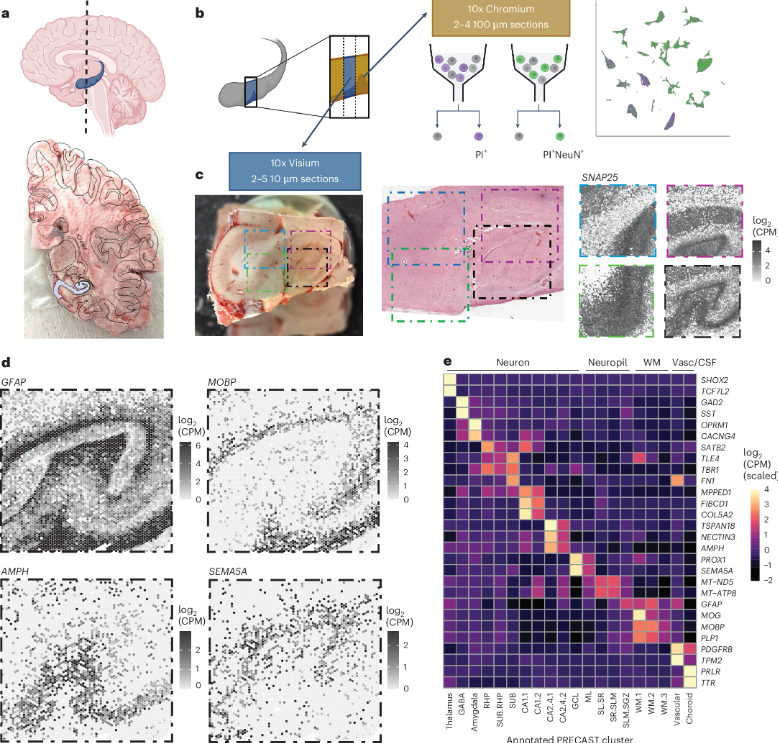
卫材与渤健推进仑卡奈单抗皮下给药申请,为阿尔茨海默病治疗带来新选择


2025年9月4日,卫材(Eisai)与渤健(Biogen)联合宣布,已向美国FDA提交仑卡奈单抗(lecanemab)皮下自动注射剂型(SC-AI)IQLIK作为每周一次给药方案的补充生物制品许可申请(sBLA)。该申请被授予快速通道资格,为阿尔茨海默病患者提供更加便捷的治疗选择。仑卡奈单抗目前用于治疗轻度认知障碍(MCI)及轻度痴呆的早期阿尔茨海默病(AD)患者。
支持sBLA申请的临床研究背景
此次补充申请基于仑卡奈单抗在针对早期阿尔茨海默病患者开展的3期Clarity AD试验及其开放标签扩展研究(OLE)中表现出的多剂量皮下(SC)给药数据。研究评估了皮下制剂作为静脉注射(IV)治疗的替代方案的有效性和安全性。申请中重点提出了每周皮下给药方案(500mg两次250mg注射),显示出简化治疗流程的潜力,为患者与护理者提供了便利。
自动注射剂型亮点:在家治疗的可能性
目前仑卡奈单抗的皮下自动注射剂型注射时间仅需约15秒,相比需要护士监督的静脉注射方案,减少了输液准备及现场护理需求:
治疗便捷性提升:患者与照料者可在家中完成,从治疗初始阶段到维持阶段均适用,显著降低医疗负担。
更灵活的选择:既保留静脉注射(IV)治疗方案,也增加了皮下注射的便携性,有助于患者根据实际情况进行选择。
优化流程:减少了传统输液治疗中的准备时间及护士监护,简化了阿尔茨海默病的整体治疗路径。
全球进展与商业化布局
仑卡奈单抗目前已在48个国家获批上市,并在10个国家处于审评审批阶段。作为仑卡奈单抗的开发主导方,卫材负责项目的全球开发与注册申请,而商业化推广则与渤健联合进行。根据合作分工,卫材拥有最终决策权。推广中,仑卡奈单抗皮下制剂被寄予厚望,旨在解决患者临床治疗中的实际难题。
真正意义上的“简化治疗”
若皮下制剂获批,不仅为阿尔茨海默病患者提供了从医疗机构输液转向家庭自注射的选择,也为患者和其家庭成员显著减轻了治疗负担,加强了患者的治疗依从性。更便捷的治疗流程对于这种长期管理的疾病具有重要意义。
未来展望
此次FDA快速通道资格的授予,展现了仑卡奈单抗皮下制剂在阿尔茨海默病治疗中的潜在价值。如果最终获批,不仅将为全球早期AD患者提供更广泛的治疗途径,也将为更高效、患者友好的创新疗法树立新标杆。在未来,仑卡奈单抗的成功推广或将为阿尔茨海默病治疗领域的探索注入新的活力。