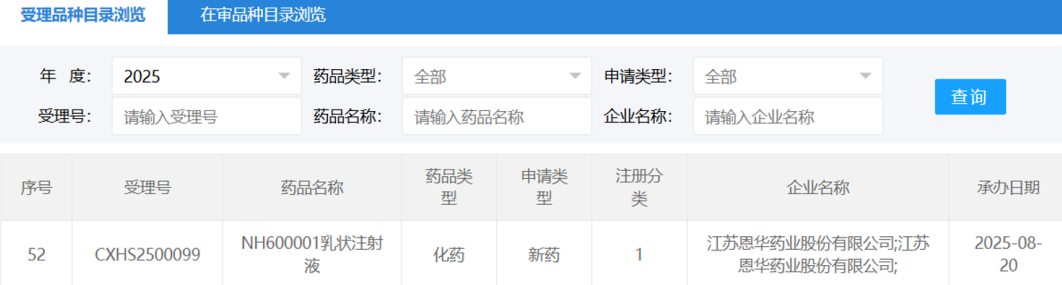
恩华药业1类麻醉新药NH600001上市申请获受理


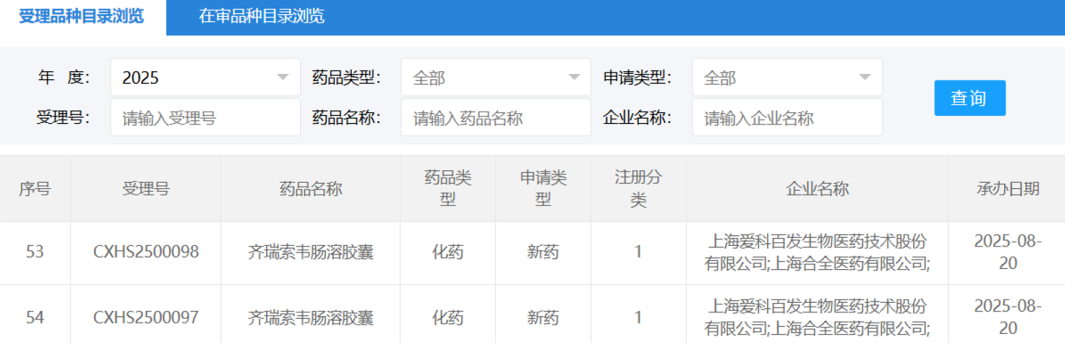
2025年8月20日, 国家药品监督管理局(NMPA)药品审评中心(CDE)官网披露,恩华药业开发的创新麻醉药NH600001乳状注射液的上市申请已正式获受理。根据此前注册性临床研究的进展信息推测,该药物此次申报的适应症主要为胃镜和结肠镜诊疗中的镇静/麻醉。
创新突破:新一代短效静脉麻醉药物NH600001
据公司公开新闻资料指出,NH600001乳状注射液分子结构与传统短效麻醉药物依托咪酯相似,但在此基础上进行了优化改进,目标是开发出一个疗效更佳、更加安全的麻醉药物。
临床前研究表明,与依托咪酯相比,NH600001不仅保留了多项优势特性,还有效克服了其使用中存在的一些关键缺点:
优势特性:麻醉起效迅速、苏醒快、安全窗大,对呼吸及循环系统影响较小;
关键改进:传统依托咪酯使用时可能引起肾上腺皮质功能抑制,而NH600001解决了这一问题,对肾上腺皮质激素无显著抑制作用,进一步提升了安全性。
关键临床研究数据支持注册
恩华药业此前针对NH600001乳状注射液已开展了两项注册性III期临床试验,验证其在不同适应症中的有效性和安全性:
胃镜和结肠镜诊疗镇静/麻醉
该试验为多中心、随机、双盲、阳性药平行对照的III期临床研究。主要评价NH600001在胃镜和结肠镜检查中的镇静/麻醉效果及其安全性。目前,该临床研究已圆满完成,初步数据显示,治疗效果令人期待。
择期手术中的全身麻醉诱导
第二个注册性临床研究于2025年4月28日首次公示,采用相似的多中心、随机、双盲、阳性药平行对照设计,旨在评估NH600001用于择期手术患者全身麻醉诱导的疗效及安全性。试验正在按计划推进中,其研究结果将进一步为该药物的临床价值提供支持。
临床应用前景广阔
短效静脉麻醉药在胃镜、结肠镜等诊疗操作中,以及择期手术全身麻醉诱导中,具有不可或缺的重要作用。然而,现有药物如依托咪酯虽应用广泛,但肾上腺皮质功能抑制、副作用限制了其更广泛的应用前景。
NH600001的出现,不仅保持了现有短效麻醉药物的诸多优势,还显著优化了安全性,有望解决当前临床未被满足的需求,进一步提升医疗实践的安全性和患者舒适度。
恩华药业推动创新药发展
作为国内领先的麻醉与精神类用药企业,恩华药业持续在创新药研发领域深耕细作。NH600001作为公司布局的重要研发管线,不仅标志着其在麻醉药物领域的进一步突破,也为中国自主研发1类新药树立了又一典范。
总结:NH600001上市申请意义重大
NH600001作为恩华药业潜力巨大的新一代麻醉药,在胃镜、结肠镜等诊疗镇静及择期手术全身麻醉领域均展现了良好的应用前景。这一药物成功上市后,将为临床提供更加安全、快捷的麻醉解决方案,同时推动中国创新药物在国际市场中的竞争力进一步提高。