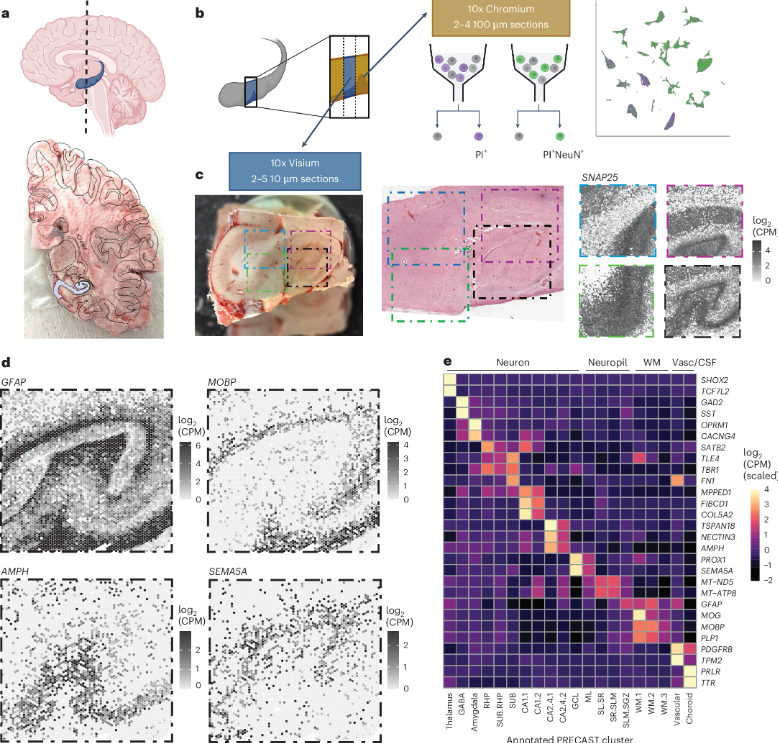
STAR-T细胞疗法研究成果发布:难治性红斑狼疮治疗迎来新突破


2025年8月27日,Nature Medicine期刊正式发布了一项具有里程碑意义的研究,论文题为《用于难治性系统性红斑狼疮的同种异体CD19靶向T细胞:一期试验》(Allogeneic CD19-targeting T cells for treatment-refractory systemic lupus erythematosus: a phase 1 trial)。该研究由徐沪济教授担任通讯作者,他同时是中国科学院院士有效候选人(提名者为西湖大学副校长及医学院院长董晨院士)。

该研究首次将新型同种异体T细胞疗法(即STAR-T细胞,代号为YTS109)应用于重症及难治性系统性红斑狼疮(SLE)合并狼疮性肾炎(LN)患者,研究结果显示该疗法能够诱导免疫系统重置,实现临床缓解,包含肾脏结构的恢复。这一成果为探索治疗严重红斑狼疮及其并发症提供了全新方向。
STAR-T细胞的研发背景:突破传统CAR-T局限性
近年来,多款自体CD19靶向CAR-T细胞疗法已被批准用于B细胞恶性肿瘤,展现了强大的疗效,并在自身免疫疾病中显示出潜在作用。然而,这些疗法的广泛应用仍面临限制,包括:
个性化生产流程复杂;
高昂成本;
基于病毒载体的CAR技术可能导致基因随机插入引发潜在风险。
为应对这些挑战,徐沪济教授团队开发了STAR-T细胞(YTS109),一种全新形式的通用型同种异体T细胞产品。他们利用CRISPR-Cas9基因编辑技术,对细胞基因组进行了多重优化:敲除TRAC、PD1、HLA-A、HLA-B和CIITA基因,并精确整合CD19靶向合成TCR和抗原受体(STAR)至TRAC位点,从而实现类似天然TCR的高效信号传导。这种设计显著降低了免疫原性和治疗的复杂性,为细胞疗法带来了更高安全性和经济可行性。
临床试验设计:重症患者的全面评估
作为一项针对多种疾病队列的试验的一部分,该研究共纳入5名严重难治性系统性红斑狼疮(SLE)合并狼疮性肾炎(LN)的患者。研究设计包括以下步骤:
进行淋巴细胞耗竭治疗以清除患者的病变免疫细胞。
每千克体重输注3×10⁶ STAR⁺ T细胞的剂量。
观察主要终点指标——安全性以及治疗后第3个月的系统性红斑狼疮应答指数4(SRI-4)。
观察次级终点指标——至第6个月时的临床缓解及生活质量改善。
研究结果:显著安全性与疗效
该研究结果显示YTS109疗法疗效突出,且安全性良好:
安全性表现:治疗过程中未出现严重的不良事件,仅发生轻度的细胞因子释放综合征(CRS),且未观察到移植物抗宿主病(GvHD)。
疗效指标:
所有5名患者在第3个月时均达到SRI-4应答,并持续至第6个月。
其中4名患者的系统性红斑狼疮疾病活动评分显著降低(平均数值从31.30降至5.35),仅1名患者在第6个月出现轻度难治性复发。
肾活检证实炎症消退,肾脏组织修复情况良好。
此外,患者生活质量在治疗后得到明显改善,经4种评估工具监测,所有5名患者的健康状况在细胞输注后的第6个月均显著提升。
研究意义:为难治性红斑狼疮患者提供新曙光
该项研究结果表明,STAR-T细胞医疗技术,不仅在其安全性上达成突破,还能够有效诱导免疫重置,缓解难治性系统性红斑狼疮及并发狼疮性肾炎患者的病程,包括实现肾脏结构恢复。这些重大进展为治疗重症红斑狼疮患者提供了一种有潜力的新疗法。
未来展望:推动通用型细胞疗法的发展
此次STAR-T细胞疗法的成功展示了通用型T细胞疗法在复杂自身免疫疾病中的巨大潜力。随着技术的不断成熟,低免疫原性的通用细胞产品将成为下一代精准医疗的核心之一。该研究的突破为未来细胞治疗的发展方向奠定了基础,同时为全球患者群体带来了新的希望。这也进一步验证了基因编辑技术在免疫及细胞疗法领域的潜力,推动中国在生物医学领域迈向新高度。