赛诺菲重磅药物Wayrilz获FDA批准,首次用于治疗免疫性血小板减少症(ITP)


8月29日,赛诺菲宣布其口服BTK抑制剂Rilzabrutinib(商品名:Wayrilz)获得美国食品药品监督管理局(FDA)批准,成功用于治疗对既往治疗效果不佳的持续性或慢性免疫性血小板减少症(ITP)成人患者。这是全球首款获批针对ITP治疗的BTK抑制剂,为难治性ITP患者带来突破性治疗选择。目前,Rilzabrutinib已在中国申报上市,受到市场广泛期待。

Wayrilz:全球首款BTK抑制剂专注ITP治疗
Rilzabrutinib由Principia Biopharma开发,是一种口服、可逆性、共价结合的布鲁顿酪氨酸激酶(BTK)抑制剂。BTK广泛表达在B细胞、肥大细胞及与先天免疫相关的其他细胞中,对于免疫性疾病的发病机制起到关键作用。
该药物通过减少自身致病性抗体的产生以及抑制巨噬细胞介导的血小板破坏,有效治疗免疫性血小板减少症(ITP)相关并发症。ITP是一种严重的自身免疫血液疾病,其特征为血小板计数显著降低,并伴随较高的出血风险和其他并发问题。赛诺菲在2020年以36.8亿美元收购Principia Biopharma后,将Rilzabrutinib纳入其创新药物组合,为全球ITP患者带来新的治疗希望。
III期临床试验:显著提升血小板应答
FDA的批准基于Wayrilz在III期LUNA 3研究中的积极数据。这是一项随机、多中心、双盲、安慰剂对照临床试验,研究纳入202名既往接受过治疗的持续性或慢性ITP成人和青少年患者。患者的基线血小板计数为15000/μL(远低于正常标准150000-450000/μL)。研究主要目标是评估在没有应用其他紧急治疗的情况下,Rilzabrutinib是否能显著提高患者在24周双盲治疗期内的持久血小板应答比例。
实验结果令人振奋:Rilzabrutinib组患者中有23%实现了持久血小板应答,而安慰剂组则为0%(P<0.0001)。此外,Rilzabrutinib还表现出更快速的疗效,研究显示,Rilzabrutinib组64%的患者在治疗最初12周内实现血小板应答,显著高于安慰剂组的32%,中位应答时间仅为15天。这些结果不仅展现了其在ITP治疗中的优势,也具备高度的临床意义和统计学价值。
安全性:数据继续保持一致
在安全性方面,Wayrilz表现优秀,显示出与先前研究一致的安全特征。在试验中,未观察到明显的不良事件激增,同时患者对药物的耐受性良好,进一步巩固了Rilzabrutinib作为长期用药的潜力。
ITP的临床需求与生活改善
免疫性血小板减少症(ITP)是一类严重的获得性自身免疫性血液疾病。ITP患者中,自身抗体导致的血小板破坏和抑制血小板生成不可同时逆转,因此导致血小板计数低于100000/μL,这不仅增加了出血风险(如颅内出血等危及生命的并发症),还严重影响患者生活质量,如易疲劳、认知功能障碍等。
目前,针对ITP的可用治疗手段有限,疗效往往不理想。Wayrilz为难治性及慢性ITP患者带来了全新的治疗选择,其显著的疗效和良好的安全性,为患者改善症状、维持生活质量提供了更多保障。
中国市场展望:期待Wayrilz早日获批
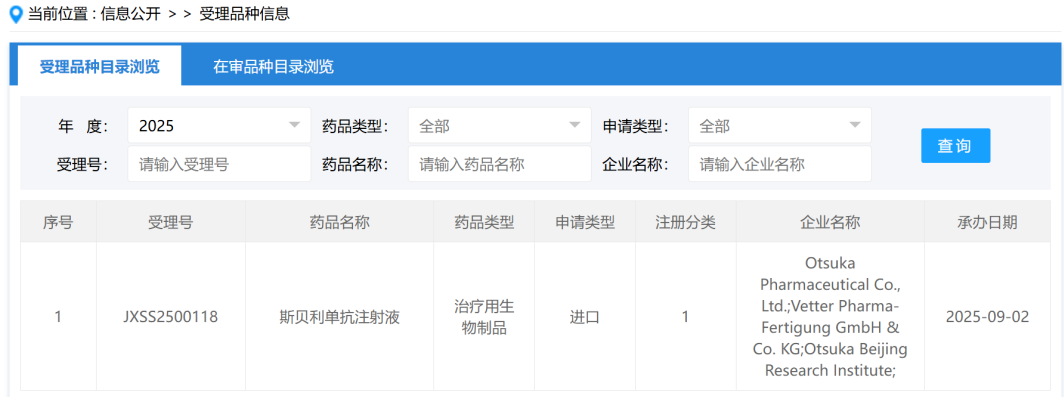
Wayrilz已在中国申请上市,随着III期研究结果的发布和FDA批准的获得,其进入中国市场无疑将进一步加强赛诺菲在血液疾病领域的竞争力。目前,中国市场ITP治疗领域尚未有同类BTK抑制剂商业化产品,Wayrilz的获批将填补这一领域的市场空白,造福更多免疫性血小板减少症患者。
总结:Wayrilz推动ITP治疗新格局
赛诺菲Wayrilz的成功上市,不仅为广大的ITP患者带来了新的生存希望,也为BTK靶向疗法在其他免疫性疾病治疗中的探索开辟了可能性。未来,Wayrilz有望进一步拓展适应症,帮助更多患者摆脱疾病困扰,同时推动ITP诊疗领域实现从传统治疗到创新疗法的跨越式发展。这一疗法的成功,或将在全球范围内掀起免疫性疾病治疗领域的新革命。