第一三共德曲妥珠单抗(T-DXd)新适应症获CDE受理


2025年11月5日,国家药品监督管理局药品审评中心(CDE)官网显示,第一三共制药注射用德曲妥珠单抗(DS-8201a,T-DXd,100mg/瓶)的新适应症上市申请已正式获受理。该适应症拟用于联合帕妥珠单抗治疗不可切除或转移性HER2阳性成人乳腺癌患者的一线方案。
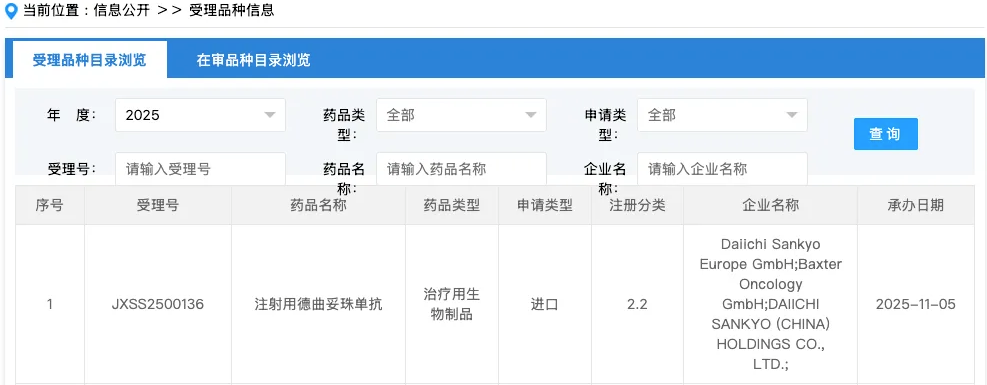
这意味着,德曲妥珠单抗有望进一步拓宽其在乳腺癌治疗领域的临床应用,为HER2阳性患者提供更具潜力的治疗选择。
德曲妥珠单抗:持续扩展中国适应症版图
德曲妥珠单抗(T-DXd)于2023年2月在中国首次获批上市,用于治疗HER2阳性乳腺癌。本次申请是该药在中国递交的第八个适应症,同时也是其在国内的第五个乳腺癌适应症。
作为一种创新型抗体偶联药物(ADC),德曲妥珠单抗在全球范围内已展现出显著的临床价值,正在被广泛研究应用于多种HER2相关肿瘤。
基于DESTINY-Breast09研究结果
此次适应症扩展申请的主要临床依据来自于DESTINY-Breast09(简称DB-09)研究的中期分析结果。该研究是一项全球多中心、随机、III期临床试验,旨在评估T-DXd联合或不联合帕妥珠单抗,与标准治疗方案(SoC THP:紫杉烷+曲妥珠单抗+帕妥珠单抗)在HER2阳性晚期或转移性乳腺癌患者一线治疗中的疗效与安全性。
研究设置了三组方案,T-DXd组对帕妥珠单抗的使用实施双盲设计。主要终点为由独立盲法影像评审委员会(BICR)评估的无进展生存期(PFS),关键次要终点为总生存期(OS)。
有望改写HER2阳性乳腺癌一线治疗格局
目前,HER2阳性乳腺癌的一线标准治疗方案以曲妥珠单抗+帕妥珠单抗+化疗药物为主。然而部分患者对传统疗法反应有限或耐药性较强。T-DXd凭借其高效精准的ADC技术平台,可实现更强的抗肿瘤活性与可控的安全性,有望在未来一线治疗中成为新的选择。
专家指出,若本次申请获批,T-DXd联合帕妥珠单抗方案有望改变HER2阳性转移性乳腺癌的治疗格局,为更多患者带来长期获益。
结语:创新ADC药物加速中国临床布局
随着德曲妥珠单抗在多个适应症上的不断拓展,中国乳腺癌治疗正步入精准化与个体化的新阶段。此次新适应症的受理,标志着全球领先ADC疗法在中国市场的进一步深化布局,也预示着HER2靶向治疗新时代的到来。