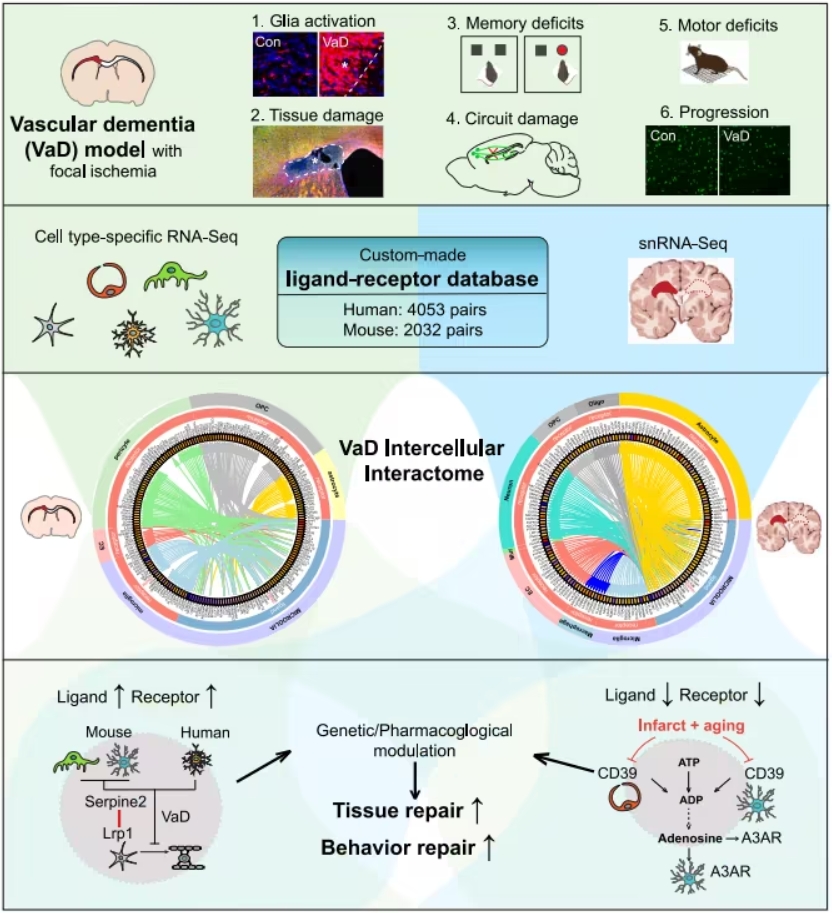
全球首款!度普利尤单抗获FDA批准用于大疱性类天疱疮治疗


6月20日,赛诺菲与再生元联合宣布,美国FDA正式批准度普利尤单抗(Dupixent)用于治疗成年大疱性类天疱疮(BP)患者的补充生物制品许可申请(sBLA)。这是全球首款获批用于治疗BP的靶向药物,为这一多发于老年人、治疗选择有限的慢性皮肤病带来新的希望。

大疱性类天疱疮:严重负担的慢性疾病
大疱性类天疱疮(BP)是一种慢性、复发性皮肤病,归因于2型炎症。BP患者主要表现为剧烈瘙痒、水疱、皮肤发红、疼痛等症状,严重时会引发皮肤出血、结痂,导致感染风险升高,并显著影响日常生活能力。这种疾病多见于老年人,目前主要依赖口服糖皮质激素(OCS)治疗,但激素长期使用可能引起不良反应,迫切需要更安全有效的治疗选择。
突破性数据支持FDA批准
度普利尤单抗此次获批基于一项II/III期ADEPT临床研究,这是一项为期52周的随机、双盲、安慰剂对照试验,涉及106名中重度BP患者,评估了度普利尤单抗(300mg,每两周一次)联合OCS的疗效及安全性。
核心研究结果:
疾病持续缓解:
在第36周,度普利尤单抗组达到疾病持续缓解的患者比例为20%,显著高于安慰剂组的4%(p=0.0114)。更新数据显示,度普利尤单抗组为18.3%,安慰剂组为6.1%。
OCS减量后的疾病稳定:
接受OCS减量后,度普利尤单抗组疾病未复发患者比例显著高于安慰剂组(59% vs. 16%,p=0.0023)。
减少救援治疗需求:
仅42%的度普利尤单抗组患者需要救援治疗,相比安慰剂组的12%,差异显著(p=0.0004)。
瘙痒症状改善:
度普利尤单抗有效减轻瘙痒症状,瘙痒明显减轻的患者比例为38.3%,显著高于安慰剂组的10.5%。
次要终点亮点:
疾病严重度: 度普利尤单抗组82%的患者疾病严重程度显著降低(p=0.0021)。
OCS使用减少: 相较安慰剂组,度普利尤单抗组的停用OCS天数(40 vs. 13天,p=0.0072)及OCS累积剂量显著缩减(p=0.0220)。
安全性分析
研究表明,度普利尤单抗治疗组总体耐受良好,不良事件(AE)发生率为96%,与安慰剂组相当。值得注意的是,度普利尤单抗组未报告死亡病例,而安慰剂组中有2例因不良事件去世。常见不良反应包括外周水肿、关节痛、上呼吸道感染、结膜炎等,症状多为轻度至中度。
度普利尤单抗对BP的意义
作为全球首个针对BP的靶向药物,度普利尤单抗不仅有效减轻BP症状,还显示了显著的激素减量支持作用,提供了一种更为安全、高效的治疗方式。这不仅填补了BP治疗领域的空白,也减少了长期依赖激素的负担,为老年患者带来了更多治疗选择。
展望未来:扩展度普利尤单抗潜力
度普利尤单抗对于2型炎症相关疾病的靶向治疗潜力已在特应性皮炎、哮喘、鼻窦炎等适应症中得到验证。此次在BP领域的突破,进一步巩固了其多适应症布局,并展现出在复杂炎症疾病管理中的高度潜力。未来,随着更多研究的推进,度普利尤单抗有望应用于更多类型的难治性炎症性疾病中,持续为患者带来新希望。
随着这一药物的应用推广,大疱性类天疱疮患者的生活质量有望显著提升,同时为其他难治性皮肤病的创新治疗提供重要借鉴,开启免疫药物研发的新篇章。