Cell研究发现血管性痴呆新治疗靶点,炎症“刹车”或成大脑修复关键


随着全球人口老龄化加速,痴呆症已成为一项严峻的公共健康挑战。目前,全球约有5000万人患有痴呆症,预计到2050年这一数字将攀升至1.52亿。血管性痴呆(VaD)作为仅次于阿尔茨海默病的第二大痴呆类型,占所有痴呆病例的10%至20%,且常伴随阿尔茨海默病,形成“混合型痴呆”。
尽管如此,与阿尔茨海默病相比,血管性痴呆的研究和治疗进展相对滞后,目前尚无有效药物能够促进患者康复,病情恶化常因脑损伤区域逐步扩展而加剧。近日,发表在《Cell》期刊的一项重要研究揭示了血管性痴呆中一种关键的大脑修复机制,指出这可能成为一种全新治疗靶点,或为患者带来突破性疗法。
研究亮点:揭示血管性痴呆的“相互作用组”
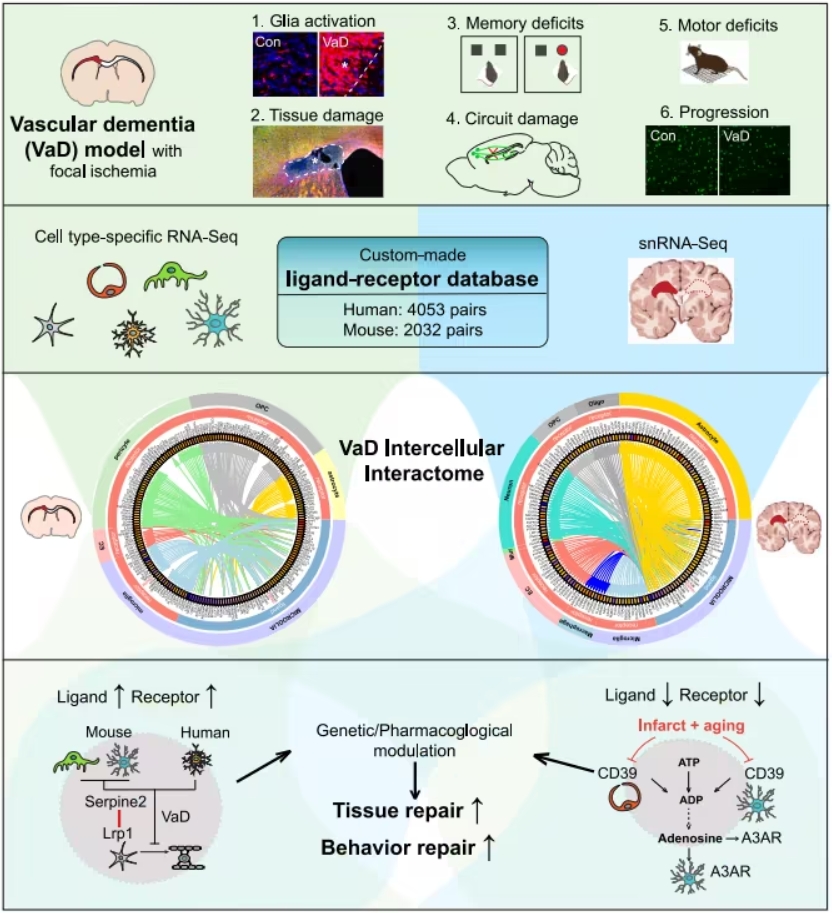
这项研究由加州大学洛杉矶分校等机构研究人员主导,结合实验室小鼠模型与人类病变数据,通过精准的转录组学和功能分析,深入挖掘了血管性痴呆病变区域内细胞间的相互作用机制。研究人员构建了一套配体-受体数据库,对跨物种的信号通路进行识别和分析,从而锁定了血管性痴呆中的两个关键细胞信号系统:Serpine2-Lrp1和CD39-A3AR。
Serpine2-Lrp1通路
研究发现,在血管性痴呆中,Serpine2的表达减少能够增强少突胶质细胞祖细胞(OPC)的分化,从而促进脑组织修复。
CD39-A3AR通路
CD39是一种能通过酶促作用生成腺苷分子的关键酶,而腺苷分子通过结合腺苷A3受体(A3AR)参与炎症调节。在血管性痴呆患者和模型中,血管细胞与小胶质细胞(脑部炎症细胞)间的CD39-A3AR信号传导因衰老和血管缺血性病变的协同作用被双重抑制。这一双重抑制被认为显著加剧了脑损伤扩展和炎症反应的恶化。
A3AR激动剂:初步验证显示治疗潜力
为了进一步确认CD39/A3AR信号系统的治疗价值,研究人员引入了一种正在银屑病临床试验中测试的A3AR特异性激动剂,并在血管性痴呆小鼠模型中验证了其疗效。结果显示:
脑组织修复:激动剂显著改善病变区域的组织完整性;
功能恢复:小鼠的记忆和步态功能得到明显改善;
延迟干预同样有效:该治疗在疾病诊断较晚阶段介入,仍展现出良好的疗效。这一点尤为重要,因为血管性痴呆通常在疾病已较为严重时才被确诊。
研究表明,通过激活CD39-A3AR信号通路,可以有效减轻炎症损害,甚至逆转脑损伤,从而破解仅掩盖症状而非解决根本问题的传统治疗难题。
科学意义:细胞通讯的关键作用
在这项研究中,研究人员首次精准识别了血管性痴呆进展中细胞间通讯障碍的分子机制,展示了“从单细胞到多系统”的科学路径。不仅阐明了脑内血管、炎症细胞和胶质细胞之间的复杂交互,还为未来的精准干预奠定了基础。
研究人员进一步指出,通过优化治疗剂量和识别生物标志物,可以更加有效地跟踪治疗进展,并为潜在的治疗方法铺平道路。
挑战与未来展望
虽然当前研究成果令人振奋,但在进入人类临床试验之前仍需完成以下工作:
优化剂量设计:根据小鼠模型结果进一步确立最佳药物剂量;
探索可靠的生物标志物:开发精确的检测工具,以监控治疗效果;
验证长期效益与安全性:通过随机对照研究确认治疗在不同患者群体中的适用性与耐受性。
创新疗法的希望与应用前景
这项研究为血管性痴呆的治疗提供了一个全新视角。通过深入理解脑细胞间通讯障碍引发的病理机制,以及靶向细胞信号通路的潜力,这一突破有望推动建立针对血管性痴呆的创新疗法,为数百万患者及其家庭带来新的希望。
研究人员强调,这不仅有助于改善患者的认知和日常功能,还可能减轻家庭和社会因疾病负担带来的压力。随着进一步的研究,这一疗法或将迅速推进至临床验证阶段,为包括阿尔茨海默病合并血管性痴呆在内的混合型痴呆提供更多治疗可能。
结语:从发现到应用的新契机
这项发表在《Cell》的研究揭示了血管性痴呆领域的潜在疗法,从机制探索到治疗验证迈出了关键一步。在未来的研究中,借助更精准的药物设计和更广泛的临床试验,这种炎症“刹车机制”有望为血管性痴呆及更多神经退行性疾病患者带来改变命运的突破。