荣昌生物泰它西普再迎新突破:申报IgA肾病新适应症,或填补国内治疗空白


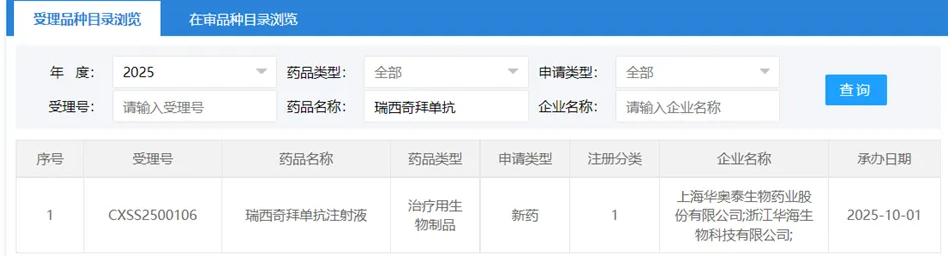
2025年10月14日,据CDE官网最新披露,荣昌生物自主研发的创新型融合蛋白药物——泰它西普(RC18),已递交新适应症上市申请。业内推测,此次申报适应症为治疗具有进展风险的原发性免疫球蛋白A肾病(IgA肾病)成人患者,旨在显著降低患者蛋白尿水平。值得注意的是,该适应症此前已被纳入优先审评通道,显示出监管层对该创新疗法的高度重视。

国内III期研究结果积极:蛋白尿显著下降55%
今年8月,荣昌生物宣布,泰它西普在原发性IgA肾病的国内III期临床研究A阶段已成功达到主要研究终点。
该研究为一项多中心、随机、双盲、安慰剂对照III期临床试验(n=318),设A、B两个阶段,评估泰它西普(240mg,每周皮下注射1次)在标准治疗基础上的有效性与安全性。
A阶段的关键结果显示:
与安慰剂组相比,泰它西普组在治疗39周后24小时尿蛋白/肌酐比值(UPCR)降低幅度达55%;
结果具有显著统计学意义(P<0.0001);
同时,受试者在治疗过程中表现出良好的耐受性与安全性。
这一成果表明,泰它西普有望成为IgA肾病领域的潜在首个靶向免疫调节生物药物。
IgA肾病治疗需求迫切:237万患者面临疾病进展风险
IgA肾病是全球最常见的原发性肾小球疾病之一,发病机制复杂,临床治疗手段有限。
根据弗若斯特沙利文预测,到2030年全球IgA肾病患者预计将超过1016万人,其中中国患者约占237万。
我国肾活检数据显示,IgA肾病约占所有病例的54.3%,且有30%-40%的患者可能在数年内进展为终末期肾病(ESRD),给社会和家庭带来沉重负担。
目前,国内尚缺乏针对IgA肾病病理机制的特异性治疗药物,临床仍以免疫抑制剂和支持疗法为主。泰它西普的出现,有望打破这一治疗瓶颈。
双靶点机制创新:同时阻断BLyS与APRIL通路
泰它西普是一种全球首创的BLyS/APRIL双靶点融合蛋白药物,通过同时抑制B淋巴细胞刺激因子(BLyS)与增殖诱导配体(APRIL),调控异常免疫反应。
研究发现,IgA肾病患者体内这两种细胞因子水平显著高于正常人群,是驱动疾病发生的关键因素。
泰它西普通过精准阻断这两条信号通路,可:
抑制B细胞过度增殖;
减少异常浆细胞数量;
降低异常免疫球蛋白生成;
从源头上减少免疫复合物沉积,缓解肾小球炎症反应。
这种机制的独特性使其成为IgA肾病免疫治疗领域的重要突破者。
已获三项上市批准,管线持续拓展
截至目前,泰它西普已获得国家药监局(NMPA)批准的三项适应症包括:
系统性红斑狼疮(SLE)
类风湿性关节炎(RA)
重症肌无力(MG)
此外,今年9月,该药物的第四项适应症(用于治疗原发性干燥综合征pSS)已递交上市申请,成为全球首个进入上市申报阶段的干燥综合征生物药。
随着本次IgA肾病适应症的申报,泰它西普的适应症布局进一步完善,也标志着荣昌生物在自身免疫疾病治疗领域的研发管线持续深化与拓展。
结语:国产创新药加速崛起,助力肾病治疗新格局
泰它西普在IgA肾病领域的最新进展,不仅展示了中国生物医药企业在创新机制与临床转化方面的能力,也为广大患者带来了新的希望。
若该适应症最终获批,将成为中国首个双靶点IgA肾病治疗生物药,有望显著改善患者预后,推动我国肾脏疾病治疗体系的创新升级。