Rybelsus获FDA批准新适应症:首款可降低心血管风险的口服GLP-1药物问世


10月18日,诺和诺德(Novo Nordisk)宣布,美国食品药品监督管理局(FDA)正式批准Rybelsus(口服司美格鲁肽)用于降低2型糖尿病高风险成人患者发生重大不良心血管事件(MACE)的风险——包括心血管死亡、心肌梗死以及中风。无论患者是否有既往心血管病史,这一适应症均适用。
此次批准标志着Rybelsus成为全球首款能显著降低MACE风险的口服GLP-1受体激动剂。
关键数据来自SOUL IIIb期临床研究
FDA的批准主要基于SOUL III期研究的积极结果。该研究旨在评估每日14 mg口服司美格鲁肽在标准治疗基础上对2型糖尿病高危患者减少MACE风险的疗效。主要研究终点为首次发生心血管死亡、非致死性心肌梗死或非致死性中风的时间。
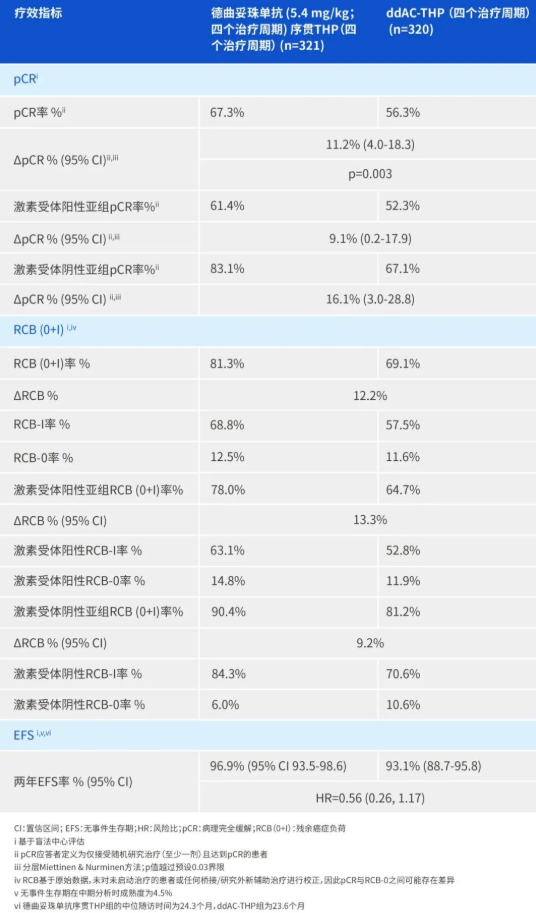
研究共纳入9650名受试者(每组4825人)。结果显示:
司美格鲁肽组共有579例(12.0%)发生MACE事件;
安慰剂组共有668例(13.8%)发生MACE事件;
结果显示,口服司美格鲁肽可使MACE风险相对降低14%(HR=0.86,95% CI:0.77–0.96,p=0.006)。
从绝对风险角度看,口服司美格鲁肽在3年时可使心血管事件的风险下降约2%,且差异具有统计学意义。

安全性表现良好,与既往数据一致
在安全性方面,SOUL研究的结果与此前口服司美格鲁肽的临床数据一致。研究期间,口服司美格鲁肽组的整体严重不良事件(SAE)发生率为47.9%,低于安慰剂组的50.3%。
最常见的严重不良事件包括:
心脏疾病相关事件:17.8%(司美格鲁肽组)vs 19.8%(安慰剂组)
感染或寄生虫相关事件:15.0% vs 16.5%
同时,胃肠道不良反应略有上升(5.0% vs 4.4%),但总体耐受性良好,未出现新的安全性信号。
专家点评:为糖尿病心血管防治开创新局
业内专家认为,Rybelsus的这一新获批是糖尿病治疗领域的里程碑式进展。传统GLP-1药物多为注射剂型,而Rybelsus作为首款可口服服用的GLP-1受体激动剂,不仅提升了患者依从性,还首次在临床上证实其具有明确的心血管获益。
这意味着,未来在2型糖尿病高危人群中,医生可通过口服给药的方式同时实现血糖控制与心血管保护双重目标,极大改善患者长期预后。
结语:糖尿病治疗迈入“心血管保护新时代”
Rybelsus最早于2019年获批用于改善2型糖尿病成人患者的血糖控制,而此次新增适应症的通过,进一步拓宽了其临床应用场景。
随着SOUL研究结果的公布,Rybelsus正式成为首个获得FDA批准、可降低心血管事件风险的口服GLP-1药物,为2型糖尿病的综合管理打开了全新篇章。
未来,Rybelsus或将成为兼具降糖、减重与心血管保护三重功效的代表性药物,为数以百万计的糖尿病患者带来切实获益。