腰痛真相新发现:Runx1基因或是“椎间盘早衰”的幕后黑手


是否也曾被突如其来的腰痛困扰?弯腰、久坐、甚至夜里翻身都可能被疼痛惊醒。事实上,这并非小问题——全球约有 5.4 亿人 正受腰痛折磨,其中约四成的原因,都源自脊柱间的“缓冲装置”——椎间盘退变。
椎间盘就像脊柱的“减震垫”,依靠中心髓核中的类脊索细胞分泌Ⅱ型胶原蛋白与聚集蛋白来维持弹性和含水量。但随着年龄增长,这个“水垫”会慢慢漏气干瘪,使脊柱失去支撑,从而引发疼痛与僵硬。
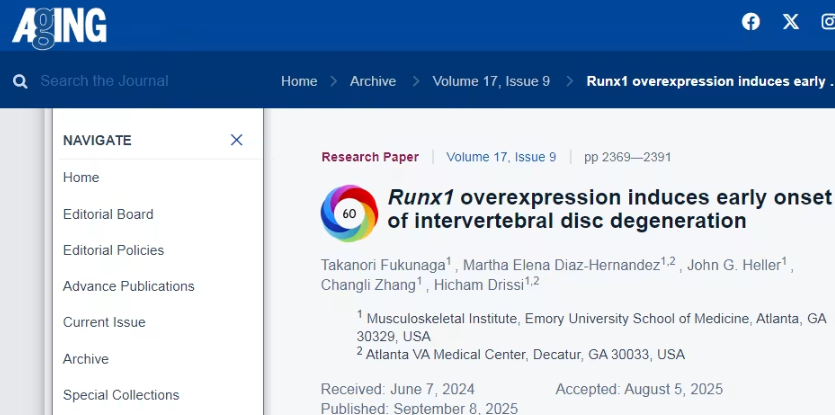
不过,最新研究正在改写传统认知。近日,美国埃默里大学医学院团队在《Aging》期刊发表研究指出,真正加速椎间盘衰老的“幕后推手”,不是机械劳损,而是一个关键基因——Runx1。它像一个“主控开关”,同时诱导髓核细胞“身份错乱”与“提前衰老”,从根源推动椎间盘退变。
Runx1让年轻椎间盘也“未老先衰”
为了揭示Runx1的真实作用,研究团队设计了特殊的小鼠模型——Krt19CreERT; Rosa26-Runx1。通过他莫昔芬诱导,他们能让Runx1在髓核细胞中被精准激活。
实验发现:正常小鼠需约18个月(相当于人类老年期)才出现椎间盘退变,而Runx1激活组在仅5个月(人类青壮年阶段)时,椎间盘就已明显“老化”——髓核萎缩、纤维环裂开,与自然老化小鼠极为相似。
髓核细胞“转错行”,从修复者变成“破坏者”
在显微镜下,研究人员观察到惊人的变化:Runx1激活后,原本专注分泌保水物质的类脊索细胞开始“职业转型”,变成肥大的软骨样细胞。这些细胞丢掉了维持弹性的Ⅱ型胶原蛋白与聚集蛋白(下降超60%),反而过量生成Ⅹ型胶原蛋白,促使髓核组织逐渐硬化。
更糟糕的是,这些细胞并未死亡,而是进入衰老停滞状态——不再履行功能,却持续释放IL-6、TNF-α等炎症因子,破坏周围环境,进一步加速退变。免疫染色结果显示,衰老标志蛋白P16与P21水平升高约三倍,证实Runx1通过诱导细胞衰老而非杀伤作用来推动疾病发展。
“剂量越高,衰老越快”:Runx1的线性控制效应
研究还发现了明确的剂量-效应关系:注射他莫昔芬次数越多,Runx1激活程度越高,小鼠椎间盘退变也越严重。换言之,Runx1活性就像“衰老油门”——踩得越狠,退变越快。这一发现让Runx1从“参与者”晋升为真正的“主导者”,揭示了椎间盘退化的全新分子机制。
三大启示:从检测到逆转,Runx1开启腰痛治疗新篇章
早期风险预警
检测髓核组织中Runx1的表达水平,有望成为评估椎间盘退变风险的生物标志物。例如,久坐办公人群若检测到Runx1活性升高,可及早干预、延缓病变。
靶向治疗开发
通过研制Runx1抑制剂,可像为基因“加刹车”,从源头阻断衰老进程。这类药物有望实现真正的“治本”,而不仅仅缓解疼痛。
抗衰新路径:清除衰老细胞
针对Runx1诱导的“僵尸细胞”,可借助细胞清除疗法或炎症因子抑制策略,阻断“衰老→炎症→退变”的恶性循环,帮助椎间盘恢复健康状态。
从“治标”到“治本”:重写腰痛的未来
这项研究颠覆了过去“椎间盘老化无法逆转”的观点。椎间盘退变其实是一个由Runx1主导的分子事件:髓核细胞先被迫“改行”,继而陷入衰老,最终失去弹性与保水功能,腰痛便由此而生。
正如研究负责人 Drissi 教授 所言:
“理解Runx1如何调控细胞衰老,是找到真正有效治疗手段的第一步。未来我们也许能像控制血糖那样,精准调节Runx1活性,让椎间盘老得更慢。”
结语
下次感到腰酸背痛时,别只以为是“坐太久”。
你的髓核细胞或许正被Runx1推着提前老化。
这项研究让科学家们离“从基因层面治好腰痛”的目标更近一步——
真正意义上的“逆转衰老,从脊柱开始”。