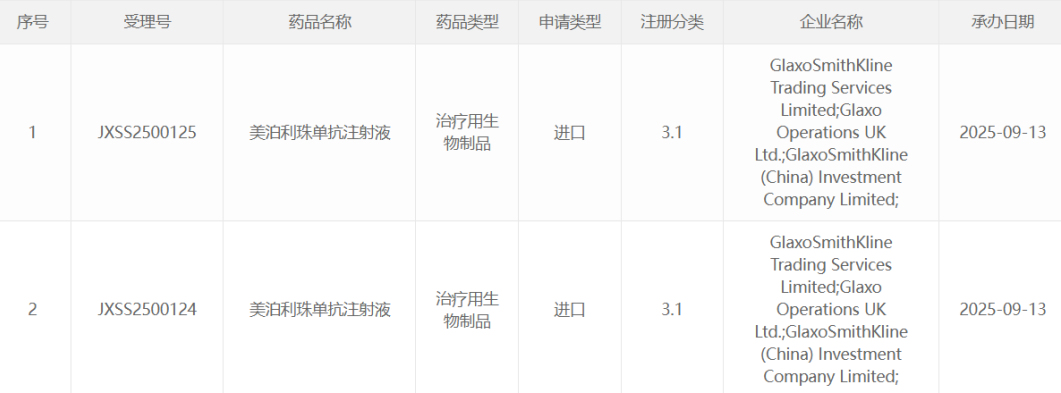
阿斯利康司美替尼口服颗粒剂在美获批 用于1岁及以上NF1相关丛状神经纤维瘤儿科患者


2025年9月10日,FDA官网显示,阿斯利康的司美替尼(selumetinib)口服颗粒剂正式获批上市,适用于1岁及以上、有症状且无法手术的1型神经纤维瘤病(NF1)相关丛状神经纤维瘤(PN)儿科患者。同时,原已批准的口服胶囊剂的适用范围也从2岁及以上儿科患者扩大至1岁及以上。这一更新为低龄患者的治疗提供了更加灵活的选择。

批准基础:多项临床研究验证药物疗效与安全性
此次批准基于以下几项研究的成果支持:
相对生物利用度研究(Study 89):该研究在健康成人中证明司美替尼口服颗粒剂与口服胶囊剂具有相似的药物暴露量。
两项I/II期研究(SPRINT和Stratum):这两项研究在2岁及以上的NF1相关PN儿科患者中证实了口服胶囊剂的疗效和安全性。
SPRINKLE研究:该研究针对1岁及以上儿科患者,专门评估了口服颗粒剂在治疗中的表现,进一步提高了药物适用人群的下限年龄。
研究结果表明,颗粒剂与胶囊剂在药物暴露量上相似,从而支持了适用人群的外推,覆盖到更低年龄层的儿科患者。
司美替尼:全球首个MEK抑制剂,用于NF1相关PN治疗
司美替尼由辉瑞子公司Array BioPharma开发,是一款针对MEK1/2的丝裂原活化蛋白激酶抑制剂(MEK抑制剂)。2020年4月,该药首次获得FDA批准,成为全球首个用于NF1相关PN治疗的药物,同时填补了这一领域的治疗空白。
商业化历程:
2003年,阿斯利康从Array BioPharma获得司美替尼的全球权益;
2017年,与默沙东达成合作,共同开发与商业化;
全球上市布局:2020年在美国获批、2021年在欧洲获批、2023年进入中国市场。
目前,司美替尼在不同地区的适用范围有所不同,例如欧洲和中国仅限于3岁及以上的NF1相关PN患者,而此次FDA批准的适应症更新则将治疗覆盖到1岁及以上患者。
司美替尼警告及安全性评价
司美替尼处方说明已包括多项警告,例如:
心肌病、眼毒性、胃肠道毒性、皮肤毒性;
肌酸磷酸激酶升高、维生素E水平升高;
胚胎毒性以及口服胶囊剂相关的出血风险增加。
此次FDA更新标明,这些警告和注意事项通过进一步数据扩展至更多儿科患者,仍未发现新的安全性信号,但提醒临床使用时需密切监测药物相关不良事件。
颗粒剂与胶囊剂的组合 为不同年龄患者提供灵活选择
随着颗粒剂的获批,司美替尼的剂型选择更加多样化,可满足不同年龄层患者的需求。颗粒剂特别适合于年龄较小、吞咽胶囊困难的1岁至2岁儿科患者,而此后的适用年龄扩展进一步提升了该药物的覆盖范围。
未来展望:专注NF1全球患者需求
NF1是一种罕见的遗传性疾病,以丛状神经纤维瘤(PN)为主要特征,严重影响患者的生活质量。通过持续扩展适用人群和剂型选择,阿斯利康再次推进NF1领域药物治疗的创新。
司美替尼的颗粒剂形式,填补了1岁至2岁NF1相关PN患者治疗上的空白,也为更广泛年龄段患者带来了有效的治疗方案。这一进展不仅巩固了阿斯利康和默沙东在全球罕见病领域的竞争力,也为更多NF1患者带来希望。