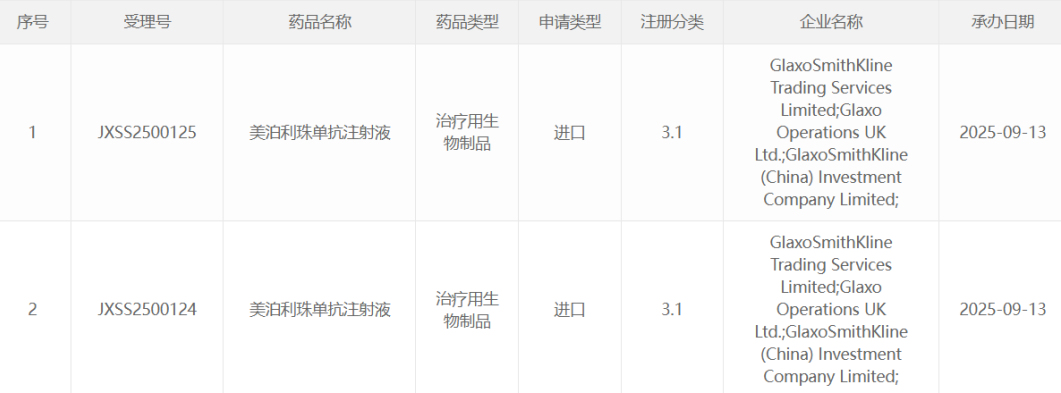
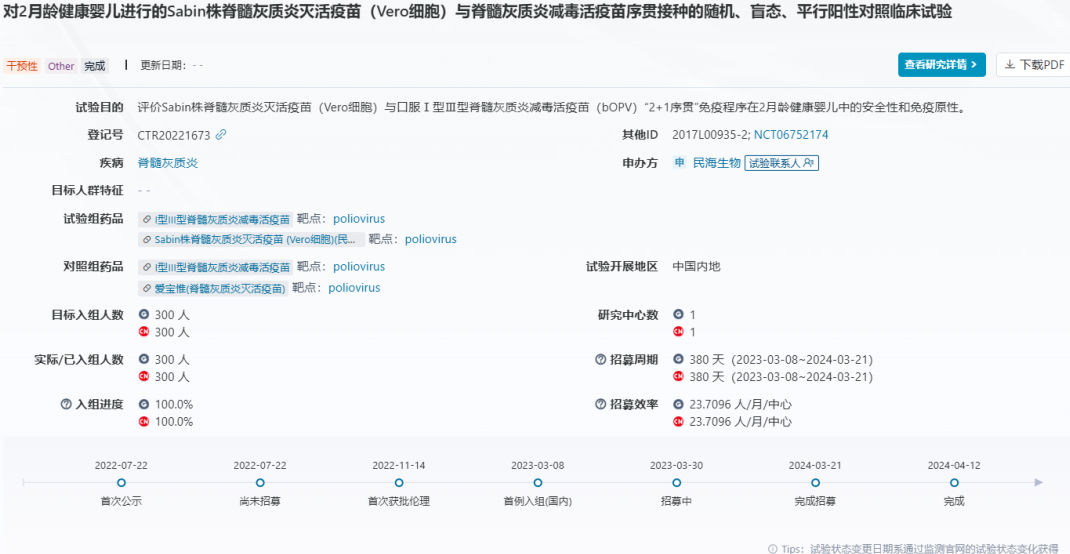
哈佛团队研发三价mRNA结核病疫苗,展现超越卡介苗的保护效果


结核病是全球首要的传染病致死原因之一,每年导致120万人死亡。尽管卡介苗(BCG)是目前全球唯一被批准用于预防结核病的疫苗,但其对青少年和成年人群体的保护效果较低。为应对这一全球公共卫生挑战,哈佛大学医学院研究团队近日在国际顶尖期刊《Cell》上发表了一项重要研究成果。研究通过挖掘人类CD4 T细胞抗原库,开发了一款三价mRNA-LNP疫苗,在小鼠模型中展现出增强并超越卡介苗的保护效果,为下一代结核病疫苗的研发指明了全新方向。

结核病的严峻挑战:疫苗研发受限
结核病是由结核分枝杆菌感染引发的慢性疾病,特别是在低收入和中等收入国家,其发病率与致死率居高不下。当前,唯一获批、应用超过100年的BCG疫苗对儿童有效,但在成年和高危人群中保护力有限。此外,潜伏性结核的大量存在,使得寻找能有效激活免疫系统的候选抗原成为疫苗开发的重大挑战。
CD4 T细胞筛选:助力疫苗抗原探索
CD4 T细胞是控制结核分枝杆菌感染的主要应答细胞,在潜伏性结核中尤为重要。哈佛研究团队通过分析潜伏性结核患者的CD4 T细胞反应,结合全基因组规模数据,建立了一种筛选疫苗抗原保护效力的新流程。
在小鼠模型的实验中,研究人员逐一验证了筛选的CD4 T细胞靶抗原,并发现了多个保护效力优异但尚未进入临床开发的抗原。这些抗原间表现出免疫交叉反应性,并具有共享CD4表位,为开发通用性更强的结核病疫苗提供了理论基础。
三价mRNA疫苗:突破传统局限
基于上述筛查结果,研究团队开发了一种三价mRNA-LNP疫苗,由**PPE20(Rv1387)、EsxG(Rv0287)和PE18(Rv1788)**三种抗原组成,通过脂质纳米颗粒递送至机体。实验数据显示:
保护增强:在多种小鼠模型中,该mRNA疫苗显著增强了对结核分枝杆菌的免疫保护;
效果超越卡介苗:相比单独接种卡介苗,三价mRNA疫苗展现出更强的保护作用,显著减少了结核杆菌的菌负荷。
此外,研究还证明,84%的结核分枝杆菌暴露者对上述抗原产生了细胞免疫反应,进一步验证了该疫苗在人类中可能具有相似效果。
研究意义:推动结核病疫苗免疫学与实践突破
该研究为结核病疫苗研发提供了以下关键启示:
在小鼠体内筛选的CD4 T细胞抗原有助于确定疫苗候选抗原优先级;
CD4 T细胞抗原的免疫交叉反应性反映了共享表位的潜力,或可用于开发更加广谱的疫苗;
mRNA-LNP递送技术能显著增强结核病疫苗保护力,为疫苗设计提供新的载体选择。
未来计划:迈向临床试验
基于这些实验室成果,研究团队计划启动I期临床试验,进一步测试这款三价mRNA疫苗在人类中的安全性和有效性。通过全新疫苗概念的验证,这一研究或将为全球结核病预防提供一条全新的路径。
总结:结核病疫苗研发迈向新阶段
哈佛大学医学院的这项研究为结核病疫苗免疫学提供了深刻见解,同时展示了三价mRNA-LNP疫苗的潜力。结合CD4 T细胞响应的筛选策略和mRNA递送技术,未来的结核病疫苗开发有望进一步突破,为预防结核病以及控制其全球流行提供有效解决方案。这一成果不仅为研发团队注入了信心,也为全球抗击结核病的战斗带来了新希望。