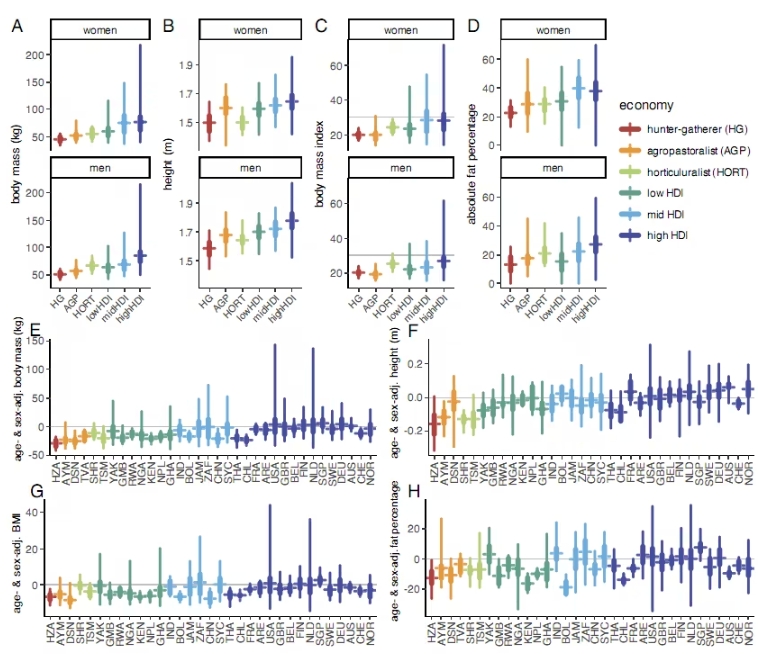
血液里的“隐形炸弹”:遗传背景与克隆性造血的癌症秘密


在每个人体内,基因如同一份生命的模板,大部分源自父母的遗传,被称为生殖系变异(germline variation)。这些“先天设定”决定了我们的基础特征,也埋下了一些关于健康的未知因素。然而,生命是一个不断变化的旅程。在细胞分裂和DNA复制的过程中,由于环境暴露、衰老等原因,新的“错误”可能被添加进来,这便是所谓的体细胞突变(somatic mutation)。
尽管我们已经知道癌症是先天遗传与后天突变共同作用的结果,但两者如何交织作用、推动癌症的发生,始终是科学界亟需破解的谜题。近日,发表在《Nature Genetics》上的一项重磅研究,揭示了遗传变异如何引导体细胞突变的演化,并将其转化为癌症风险。这项覆盖超过73万人的研究,不仅刷新了人们对癌症起源的认知,还为精准医学和早期干预提供了全新思路。

遗传背景与体内突变的“双重作用”
血液系统中的“种子细胞”
我们的造血系统如同一个繁忙的细胞工厂,由造血干细胞(hematopoietic stem cells)主导。这些种子细胞在不断产生新的血液细胞(红细胞、白细胞和血小板),维持着生命的正常运行。然而,随着年龄增长,一些造血干细胞可能发生特定突变。如果这些突变提供了生长优势,细胞将竞争性扩张,形成一个由单一突变主导的细胞群。这个过程被称为克隆性造血(Clonal Hematopoiesis,CH)。
克隆性造血:癌症来临的“警报器”
克隆性造血本身并非癌症,但它是一种“隐形警报”,特别是在老年人群中更为常见。尽管大多数携带CH的人不会发展为血液肿瘤,少数人可能因为其他因素的叠加,引发癌变。那么,到底哪些决定性因素推动了从CH到癌症的过渡?研究发现,生殖系变异是这其中的关键“幕后推手”。
超大规模研究揭示遗传与CH的相互关系
研究使用了英国生物样本库(UK Biobank) 和其他多个人群的海量数据,涵盖超73万人。以下是主要研究发现:
遗传背景与CH的直接关联
数据显示,约8%的参与者携带显性遗传的生殖系变异(PGVs),如CHEK2、ATM和BRCA2基因,这些变异显著增加了克隆性造血的风险。携带这些变异的个体患有推动血液肿瘤的CH基因突变(CH-heme)的几率比普通人高约12%。
染色体异常的风险
此外,一些生殖系变异还与染色体片段异常相关,比如拷贝数中性杂合性丢失(CNLOH)事件,风险上升约34%。这表明,遗传背景可能决定了克隆性造血的发生速度和性质。
生殖系变异如何挑选“危险突变”?
另一个重要发现是,遗传背景并不会随机推动所有突变,而是精确地“挑选”某些特定类型的突变。例如:
CHEK2变异的携带者更容易发展出DNMT3A突变的克隆性造血。
ATM基因变异携带者则倾向于出现11q染色体的杂合性丢失(CNLOH),而ATM本身正位于11q染色体上。
这一现象被称作“二次打击”效应:首次打击来自遗传背景(导致其中一条染色体的抑癌基因失效),随后进一步的突变将剩余的保护机制完全摧毁。研究揭示了遗传与体细胞突变之间的高度专一性,共同“筛选”出最危险的癌前事件。
从“杂草”到“森林大火”:癌症风险预测的关键桥梁
是否引发癌症最终是判断克隆性造血影响的重要标准。研究显示,在携带遗传变异的人群中:
如发现“生殖系选择的CH”突变(与遗传背景高度相关的突变),发展为血液肿瘤的风险显著升高。
CHEK2携带者的髓系肿瘤风险上升至普通人的3.3倍,淋巴系肿瘤的风险高出2.1倍。
一些新发现的遗传基因(如XRCC2、SLX4)也被证实与肿瘤高度相关。
研究进一步指出,发现克隆性造血状态的个体,尤其是“生殖系选择CH”携带者,其血液肿瘤的25年绝对风险可能高达30%-46%,而普通人仅为0.2%-4%。这为筛选高危人群提供了精准的靶向工具。
临床启发:精准预测与早期干预
通过联合遗传基因测序和克隆性造血检测,未来可以更高效地筛选出癌症高危个体,提前实施个性化筛查和干预。数据表明:
在普通人群中找到绝对癌症风险超过5%的个体,需要筛查454人;
在CHEK2携带者中仅需筛查48人即可找到一例高风险者,筛查效率提升近10倍。
这一发现的临床意义深远。结合遗传与克隆性造血的“双重印记”,不仅能提前识别潜在患者,还可能开发针对特定高风险人群的个性化药物预防方案。
结语:绘制癌症风险的“双重剧本”
这项研究首次揭示了遗传基因如何塑造体细胞突变的路线图,将其转化为个体化的癌症风险。这不仅让我们看到了癌症发生机制的新侧面,也为精准医学铺设了未来方向。通过解析遗传和体细胞突变之间的“共谋”,人类对癌症的预测、预防和干预迈出了更坚实的一步。
这不仅仅是科技的一小步,更可能是改变人类与癌症关系的一大步。